Периодичность атомных характеристик.
Атомный радиус. За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. При изучении строения молекул и кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный радиус, зависящий от типа химической связи. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента.
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более ярко, чем у d- и f-элементов, поскольку d- и f-электроны внутренние. Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием. Следствием f-сжатия является то, что атомные радиусы электронных аналогов d-элементов пятого и шестого периодов практически одинаковы:
| ||||||
| Таблица 2.3. |
Эти элементы из-за близости их свойств называются элементами-близнецами.
Образование ионов приводит к изменению ионных радиусов по сравнению с атомными. При этом радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов. Ковалентный радиус равняется половине межатомного расстояния в молекулах или кристаллах простых веществ. Ионные радиусы элементов представлены в табл. 2.4.
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
Энергия ионизации I выражается в кДж∙моль–1 или эВ∙атом–1. Значение I в электронвольтах численно равно потенциалу ионизации, выраженному в вольтах, поскольку E = e–·I.
Э+ – e– = Э+, ΔH = I1 – первый потенциал ионизации; Э – e– = Э2+, ΔH = I2 – второй потенциал ионизации и т.д. I1 < I2 < I3 < I4...
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
| ||||||||||||||||||||||||||||||||||||||||||||
| Таблица 2.5. Потенциалы (энергии) ионизации I1. |
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рис. 2.4).
I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду I1 резко понижается – он минимален у щелочных металлов.
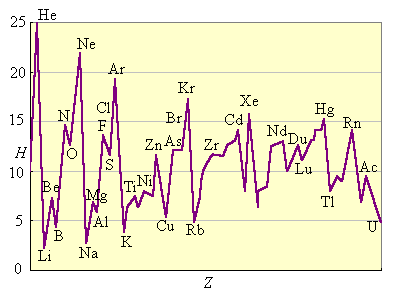 |
| Рисунок 2.4. Потенциалы ионизации нейтральных атомов. |
Энергия связи электрона с ядром пропорциональна Z и обратно пропорциональна среднему (орбитальному) радиусу оболочки. Атомные радиусы d- и f-элементов с ростом Z в периоде уменьшается незначительно по сравнению с s- и p-элементами, поэтому их потенциалы ионизации растут также незначительно.
В главных подгруппах потенциалы ионизации с ростом Z уменьшаются вследствие увеличения числа электронных подоболочек и экранирования заряда ядра электронами внутренних подоболочек.
В побочных подгруппах d-электроны экранируются не только электронами заполненных оболочек, но и внешними s-электронами. Поэтому потенциал ионизации d-элементов с ростом Z в подгруппе увеличивается, хотя и незначительно.
Чем меньше потенциал ионизации, тем легче атом отдает электрон. Поэтому восстановительная способность нейтральных атомов с ростом Z в периоде уменьшается, в главных подгруппах растет, а в побочных – падает.
Энергия сродства к электрону. Другой важной в химии характеристикой атома является энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону E значительно сложнее, чем определение энергии ионизации. Величины E (в эВ) для некоторых атомов приведены ниже:
| ||||||||||||||||||||||
| Таблица 2.6. Значение энергии сродства к электрону E для некоторых атомов. |
Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных подоболочек. Самый сильный из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов VII группы).
Отметим, что в отличие от ионизации присоединение двух и более электронов энергетически затруднено, и многозарядные одноатомные отрицательные ионы в свободном состоянии не существуют.
Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2 и s2p6 и переходные элементы. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 2.7. Электроотрицательность элементов. |
В главных и побочных подгруппах свойства элементов меняются немонотонно, что обусловлено так называемой вторичной периодичностью, связанной с влиянием d- и f-электронных слоев.
Из анализа периодичности геометрических и энергетических параметров атомов следует, что периодическим законом можно пользоваться для определения физико-химических констант, предсказывать изменение радиусов, энергий ионизации и сродства к электрону, и, следовательно, кислотно-основные и окислительно-восстановительные свойства их соединений.
Ионные радиусы элементов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 2.4. Ионные радиусы элементов. |
Выполнить вопросы №9, №10 из теста.
Тема 3: Химическая связь.
Цель:
1. Ознакомиться с определениями длина, угол и энергия связи.
2. Научиться характеризовать все виды химической связи.
3. Ознакомиться с основными правилами метода молекулярных орбиталей (МО).
4. Ознакомиться с определениями связывающими, не связывающими и разрыхляющими МО.
5. Ознакомиться со схемами распределения электронов по МО в молекулах H2, Li2, B2C2, O2, LiH и МО N2, CO, CN–, NO+.
6. Узнать, как изменится энергия связи и межъядерное расстояние в 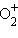 по сравнению с
по сравнению с 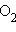 .
.
7. Научиться приводить примеры обменного и донорно-акцепторного механизмов образования ковалентной связи.
Выполнить вопросы №9, №10 из теста.
Химическая связь.
Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии по сравнению с невзаимодействующими атомами. При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности. Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь». Важнейшие виды химической связи: ионная, ковалентная, металлическая, водородная, межмолекулярная.
Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа (октет) за счет образования ионов (В. Коссель) или образования общих электронных пар (Г. Льюис).
Химическая связь характеризуется энергией и длиной. Мерой прочности связи служит энергия, затрачиваемая на разрушение связи, или выигрыш в энергии при образовании соединения из отдельных атомов (Eсв). Так, на разрыв связи H–H затрачивается 435 кДж∙моль–1, а на атомизацию метана CH4 – 1648 кДж∙моль–1, в этом случае EC–H = 1648 : 4 = 412 кДж. Длина связи (нм) – расстояние между ядрами в том или ином соединении. Обычно длина связи и ее энергия антибатны: чем больше длина связи, тем меньше ее энергия.
Химическая связь обычно изображается черточками, соединяющими взаимодействующие атомы; каждая черта эквивалентна обобщенной паре электронов. В соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию.
 |
| Рисунок 3.1. Сложение дипольных элементов в молекулах NH3 и NF3. |
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный моментμ, равный произведению элементарного заряда на длину диполя *) μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
*) Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Кл∙м) или в дебаях (D); 1D = 0,333∙10–29 Кл∙м.
Все эти факторы следует учитывать. Например, для линейной молекулы CO2 μ = 0, но для SO2 μ = 1,79 D вследствие ее углового строения. Дипольные моменты NF3 и NH3 при одинаковой гибридизации атома азота (sp3), примерно одинаковой полярности связей N–F и N–H (ОЭО N = 3; ОЭО F = 4; ОЭО H = 2,1) и сходной геометрии молекул существенно различаются, поскольку дипольный момент неподеленной пары электронов азота при векторном сложении в случае NH3 увеличивает μ молекулы, а в случае NF3 уменьшает его (рис. 3.1).
Типы химических связей.
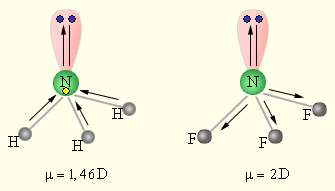
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
 |
| Рисунок 3.2. Обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи. |
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χA – χB) + 3,5(χA – χB)2, где χA и χB – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
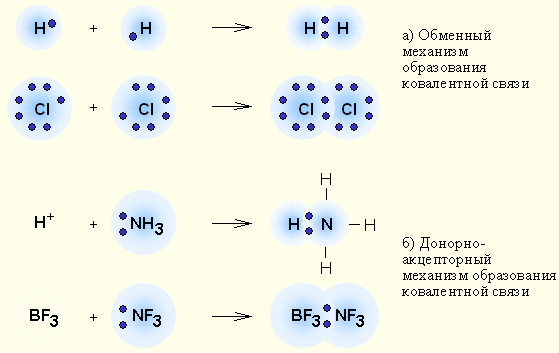
| Модель 3.1. Виды химической связи. Эта модель демонстрирует характерные особенности ковалентной и ионной химических связей. Рассмотрим сначала образование неполярной ковалентной связи между двумя атомами водорода. В электронном облаке, окружающем ядра атомов, присутствуют два электрона. Электронная плотность одинаково распределена между обоими атомами, поэтому такая связь и называется неполярной. Теперь рассмотри ковалентную полярную связь. Вы увидите, что в результате тесного сближения атомов водорода и хлора атом хлора, которому не хватает одного электрона до конфигурации благородного газа, оттянет на себя электронную оболочку атома водорода (состоящую из одного электрона). В результате на атоме хлора образуется избыточный отрицательный заряд, а на атоме водорода – избыточный положительный заряд. То есть молекула HCl представляет собой электрический диполь. Химическая связь подобного типа называется полярной ковалентной связью. Наконец, при сближении атомов натрия и хлора, которые вы также можете наблюдать в нашей модели, внешний электрон из оболочки атома натрия полностью переходит к хлору. Это вызвано тем, что не только хлору не хватает одного электрона до конфигурации благородного газа, но и у натрия имеется ровно один лишний электрон по сравнению с подобной конфигурацией. В результате атомы натрия и хлора превращаются в ионы Na+ и Cl–, связанные друг с другом кулоновскими силами. Соединения такого типа не образуют молекулу, а имеют кристаллическое строение с положительными и отрицательными ионами, поочередно расположенными в узлах кристаллической решетки. |
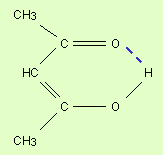
Водородная связь. Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
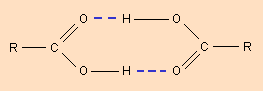
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
|
|
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль–1.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл. = 801 °C, а для NaNO3 tпл = 306,5 °C.
 |
| Рисунок 3.5. Кварц – кристаллическая форма оксида кремния. |
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.