Ионное произведение воды. Водородный показатель среды.
Ионное произведение воды, постоянная величина представляющая собой произведение
концентраций ионов водорода и гидроксид-ионов в чистой воде или в любом водном растворе при температуре 25 С
pH- это десятичный логарифм концентраций водородных ионов, взятый с обратным знаком pH=-lg[H+] или pOH=-lg[OH-] pH+pOH=14
16.Активность – эффективная концентрация вещества в растворе в соответствии с которой оно участвует в различных процессах а=f/С, где f - коэффициент активности,зависящий от ионной силы роствора М так же от природы растворителя и растворенного ве-ва от концетрации температура, С – концентрация. Ионная сила-характеристика рас-ра, учитывающая концетрации всех ионов в раствора. 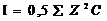 ,
, 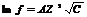 .
.
17.Растворы – это гомогенные многокомпонентные системы , не имеющие строго определенного состава. В них нет отдельных различных фаз и нет границ раздела . Если один из компонентов раствора находится в большем количестве, чем другие, то его называют растворителем. Другие компоненты в этом случае называют растворенными веществами. Растворителем считают также то вещество, агрегатное состояние которого при образовании раствора не изменяется. В зависимости от агрегатного состояния растворителя растворы бывают жидкими, газообразными и твердыми.
Процентная концентрация или массовая или объемная доля (С) когда состав раствора указывается в процентном отношении массы или объема растворенного вещества к общей массе или общему объему раствора. Молярная концентрация или молярность (См) – это число молей вещества, приходящееся на один литр раствора. Моляльная концентрация или моляльность ( m) – это число молей растворенного вещества, приходящееся на 1 кг или 1000 г растворителя. m=n/G2 моль /растворителя.
Эквивалентная концентрация (Сн) или нормальность – это число эквивалентов растворенного вещества в молях приходящееся на один литр раствора. Их значения получают делением числа эквивалентов растворенного вещества в молях на объем раствора в литрах.
18.Гидролиз– реакция соли с водой с образованием слабого электролита. Сопровождается изменением рН среды. Пример Na2CO3=Na++CO32- -диссоциация, CO32-+H2O=HCO3-+OH- - гидролиз. Гидролиз заключается в химическом взаимодействии ионов растворенной соли с молекулами воды, приводящим к образованию малодиссоциированных соединений и изменению реакции среды. Величина количественно характеризующая гидролиз, называется степенью гидролиза h.Степень гидролиза– отношение числа гидролизованных молекул соли к общему числу растворенных ее молекул. 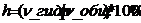 . Зависимость степени гидролиза. Концентрация вещества – чем больше разбавление, тем больше степень гидролиза. Температура – чем выше температура, тем сильнее гидролиз…………..Соли, образованные слабым основанием и слабой кислотой.
. Зависимость степени гидролиза. Концентрация вещества – чем больше разбавление, тем больше степень гидролиза. Температура – чем выше температура, тем сильнее гидролиз…………..Соли, образованные слабым основанием и слабой кислотой.
. образованные слабым основанием и сильной кислотой
. соли образованные сильным основанием и слабой кислотой
Константа гидролиза-величина постоянная,определяемая природой гидролизирующегося раствора иона.Для солей, образованных из слабого основания и сильной кислоты , а так же солей, образованных из сильного основания и слабой кислоты ,рассчитывается по уравнению К=К(воды)/К(среды)
19.Окислительно-восстановительная – реакция в процессе которой изменяются степени окисления атомов входящих в состав реагентов. Степень окисления – условный заряд атомов в соединении, что все связи в этом соединении являются ионными. Правило. Сумма степеней окисления = его заряду. .К ним относятся а) реакции замещения Zn+H2SO4=ZnSО4+H2, б) реакции разложения и соединения 2KclO3=2KCl+3O2, H2+Cl2=2HCl, в)сложные реакции взаимодействия 2 и более веществ 4FeS2+11O2=2Fe2O3+8O2. выделяют три типа. Теория основана на следующих положениях а) реакции сопровождаются переходом электронов от элемента-восстановителя к элементу-окислителю; б)Окисление-восстановление – единый взаимосвязанный процесс; в) Окисление – процесс отдачи электронов, который сопровождается повышением степени окисления элемента-восстановителя;
г) Восстановление – процесс присоединения электронов, который сопровождается понижением степени окисления элемента-окислителя. Процессы окисления и восстановления выражают полуреакциями, в которых указывается изменение степени окисления восстановителя и окислителя. Окислители. Неметаллы F2 Cl2 O2 I2 S, сложные вещ-ва с высшей степенью окисления, положительно заряженные ионы малоактивных металлов. Восстановители. Активные металлы (К, Na,Са), сложные вещества содержащие атомы неметаллов с отрицательной степенью окисления, сложные вещества содержащие элементы с переменной валентности, органические восстановители. возрастают в пределах периода слева направо. Окислители. Неметаллы F2 Cl2 O2 I2 S, сложные вещ-ва с высшей степенью окисления, положительно заряженные ионы малоактивных металлов. Восстановители. Активные металлы (К, Na,Са), сложные вещества содержащие атомы неметаллов с отрицательной степенью окисления, сложные вещества содержащие элементы с переменной валентности, органические восстановители.
20.Изменение потенциала электрода при прохождении тока называется поляризацией:ΔE=Ei – Ep.
Изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока называют концентрационной поляризацией.
Изменение потенциала, обусловленное замедленностью собственно электрохимических стадий реакций, называется электрохимической поляризацией. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая больше или равна энергии активации. Скорость электрохимических реакций напрямую зависит от энергии активации, которая может быть снижена изменением потенциала электрода по сравнению с его равновесным потенциалом, т. е. поляризацией. Чем больше поляризация – тем меньше энергия активации и тем выше скорость реакции. Связь между электрохимическим перенапряжением ∆Еэл и плотностью тока выражается уравнением Тафеля:
∆Еэл=a+b*lg(i)
Энергия активации – это некоторое избыточное количество внутренней энергии (по сравнении со с\редней) которым должна лбладать молекула чтобы прореагировать в данной химической реакции
Константа b зависит от природы реакции и температуры. Конст. а зависит от природы реакции, иатериала электрода, состава раствора и температуры.
21.Электрохим процессы делятся:
1.процессы превращений хим.энергии в электрическую(гальван.)
2.процессы превращений электрической энергии в химичекую(электролиз)
Между металлической пластиной, опущенной в раствор собственной сол, и раствором при образовании двойного электрического слоя возникает разность потенциалов,называется электродным потенциалом
Раздел химии, который изучает электрохимические процессы, называется электрохимией. Электрохимическим процессом называется процесс, при котором происходит взаимное превращение химической и электрической энергий. Ус-ва, в которых энергия хим. р-ций превращается в электрическую, называются гальваническими элементами. Ус-ва, в которых электрическая энергия превращается в хим., называются электролизёрами или гальваническими ваннами. В ус-вах обоих типов происходят ОВР, особенностью которых является то, что они происходят на электродах в двойном электрическом слое и которые пространственно разделены. Если металлическую пластину опустить в р-р соли, то между пластиной и р-ром начнется хим. взаимодействие, обусловленное тем, что полярные молекулы воды будут отрицательными полюсами ориентированы к положительно заряженным ионам кристаллической решетки металла. Результатом этого взаимодействия может быть образование дегратированных ионов металла. Процесс этот обратимый. Меn++m(H2O)↔Men+∙(H2O)m. В результате обратного перехода ионов в металл через некоторое время устанавливается равновесие. В зависимости от активности металла эта р-ция может сопровождаться образованием ДЭС, в котором пластина может быть заряжена либо отрицательно, либо положительно, а р-р соответственно либо положительно, либо отрицательно. На границе Ме-р-р возникает скачок потенциала (φ) и электродный потенциал (Е). 3 случая образования ДЭС: 1) Металл активный. В этом случае металл взаимодействует с молекулами воды. Меn++m(H2O)↔Men+∙(H2O)m+nē. 2) Металл малоактивный. [nCu]+λCu2+(H2O)m=[nCu]+λCu2++mH2O. 3) Металл инертный. Такие электроды не окисляются и являются лишь передатчиками электронов. При помещении таких электродов в р-р какого-либо электролита на границе электрод-р-р может формироваться ДЭС либо по первому, либо по второму типу
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ в электрохимии, разность электрических потенциалов на границе фаз электрод — электролит. На практике пользуются значениями т. н. относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода сравнения (напр., нормального водородного
Электродные потенциалы любых окислительно-восстановительных систем (редокс-потенциалы) можно рассчитать по уравнению Нернста:
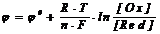 ,
,
где0 - стандартный потенциал (В), R - универсальная газовая постоянная (Джмоль-1К-1),
n - число электронов, участвующих в окислительно-восстановительном процессе, Т - температура (К), F - постоянная Фарадея (Кл), [Ox] - концентрация окисленной формы, [Red] - концентрация восстановленной формы.
22.Газовые электроды состоят из проводника 1-го рода (чаще всего платина), контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Проводник 1-го рода служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции.
H2. Равновесие на водородном электроде выражается уравнением: 2Н++2е↔Н2.
Уравнение для расчета потенциала будет иметь вид:
E=(0,059/2)*lg(a2H+/pH2), где а-активность ионов Н+ в электролите, рН2 – относительное парциальное давление водорода. Учитывая что lg(aH+)=-pH, получим
Е=-0,02951 lg(pH2)-0,059pH
O2. Для создания кислородного электрода проводник 1-го рода необходимо привести в контакт с кислородом и раствором, содержащим ионы ОН–.
O2, Pt | OH–
Если на кислородном электроде протекает реакция по уравнению O2+H2O+4e↔4OH–,то выражение равновесного потенциала имеет вид:
E=E0+(0,059/4)lg(pO2/a4OH–)
Подставляя в уравнение E0=1,23 B, aOH–=Кв/аН+, и lg(aH+)=-pH, получим
Е=1,23+0,0147 lg(pO2)-0,059pH
23. Гальванические элементы. Вычисление ЭДС и её связь с термодинамикой электродных реакций. Методы измерения электродных потенциалов. ГЭ –называются ус-ва, в которых энергия хим. р-ций преобразуется в электрическую. Состоит из двух полуэлементов, одним из которых является анод, а другой катод. Анод и катод определяются по значению Е0. Анод имеет более отрицательное значение Е0. Медно-цинковый ГЭ Даниэля Якоби. Каждый из полуэлементов представляет собой металл, опущенный в р-р собственной соли. Если два полуэлемента соединить внешним проводником, то электроны придут в направленной движение от анода к катоду. А(-): Zn0-2ē=Zn2+$ K(+): Cu2+ +2ē=Cu0. Основной кол-венной хар-кой ГЭ является ЭДС, которая обозначается ε. ε=EK-EA. Для измерения электродных потенциалов очень часто используют водородный электрод, который состоит из платиновой пластины, пов-сть которой покрыта платиновой чернью, и помещенной в р-р серной кислоты. Через р-р пропускается газообразный водород под атмосферным давлением. Н2↔2Н0; 2Н++2ē=Н02. Условно потенциал водородного электрода примем за 0. Для измерения ОВ потенциалов и электродных потенциалов создают ГЭ, в котором один электрод измеряемый, а другой – водородный.
ЭЛЕКТРОДВИЖУЩАЯ СИЛА (эдс), величина, характеризующая источник энергии неэлектростатической природы в электрической цепи, необходимый для поддержания в ней электрического тока. Эдс численно равна работе по перемещению единичного положительного заряда вдоль замкнутой цепи. Полная эдс в цепи постоянного тока равна разности потенциалов на концах разомкнутой цепи. Эдс индукции создается вихревым электрическим полем, порождаемым переменным магнитным полем. В СИ измеряется в вольтах
Законы Фарадея.1)Масса вещества, выделившаяся на электродах в результате катодной или анодной реакции, пропорциональна суммарному кол-ву электричества протекшего через электролит.
M=kQ=kIt. 2)При пропускании одинакового кол-ва электричества через растворы разных электролитов на электродах, выделяется масса вещества пропорциональная электрохимическому эквиваленту. M1/Э1=М2/Э2=const.
25.26.Электролизом называют совокупность процессов, происходящих при прохождении постоянного электрического тока через расплав или раствор электролита. Восстановительные (катодные) и окислительные (анодные) процессы происходят в соответствии с величиной электродного потенциала.
На катоде легче восстанавливаются частицы с бóльшим электродным потенциалом, на аноде легче окисляются частицы с мéньшим электродным потенциалом.
При определении процессов, протекающих на катоде при электролизе водных растворов, следует помнить:
1. Легко восстанавливаются ионы металлов с положительными значениями электродных потенциалов.
2. Ионы металлов с умеренно отрицательными значениями потенциалов (Zn2+, Fe2+, Cd2+, Ni2+ и другие) восстанавливаются одновременно с восстановлением ионов водорода (в кислой среде) или воды (в нейтральной или щелочной среде):
2H+ + 2e- H2,
2H2O + 2e- H2 + 2OH-.
3. Ионы металлов с высокоотрицательными значениями электродных потенциалов (< -1.66 В, то есть от Li+ до Al3+ в ряду напряжений) ни при каких условиях не восстанавливаются при электролизе водных растворов.
При определении анодных процессов следует помнить:
1. При использовании металлических анодов (металлы с 0 < 0.8 В) окисляется материал анода:
Me0 - n e- Men+.
2. На инертных электродах при электролизе водных растворов легко окисляются одноатомные бескислородные анионы (кроме F-).
3. Кислородсодержащие анионы при электролизе водных растворов практически не окисляются. В этих случаях идет окисление воды:
2H2O - 4 e- O2 + 4H+.
Закон Фарадея:
А)масса в-ва выделявщегося на электродах, прямо пропорциональна количеству прошедшего через электролит электричества: m=Э*Q=Э*I*t
Где m-масса в-ва, Q-кол-во Эл-ва(Кл), I-сила тока (А), t-время(с)
Э – электорохимический эквивалент в-ва, выделившегося на электродах при протекании тока силой в 1 А в течении 1сек
Б)при электролизе различных электролитов равные кол-ва Эл-ва выделяют на электродах массы в-тв, пропорциональные молярным массам их эквивалентов.
27. Химическая коррозия – коррозия обусловленная взаимодействием Ме с сухими газами или жидкостями не проводящими электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие Ме с окислителем окружающей среды. По условиям протекания коррозионного процесса различают: а) газовую коррозию – в газах и парах конденсации влаги на поверхности металла, обычно при высоких тнмпературах.
Б) коррозию в неэлектролитах – агрессивных неорганических жидкостях, таких как сернистая нефть.
Скорость химической коррозии – потери Ме в единицу времени. Зависит от многих факторов и в первую очередь от характера продуктов коррозии. Скорость коррозии возрастает с увеличением температуры из-за повышения коэффициента диффузии и изменении защитных св-тв пленки.
28 .Электрохимическая коррозии – разрушение Ме с возникновением в системе электрического тока ппри соприкосновении с электролитом. Коррозия с участием кислорода называется коррозией с поглощением кислорода (коррозия с кислородной деполяризацией). Коррозия с участием ионов водорода называется коррозией с выделением водорода (коррозия с водородной деполяризацией). Коррозия как самопроизвольный процесс протекает если изменение энергии Гиббса реакции дельтаG отриц.
Скорость химической коррозии – потери Ме в единицу времени. Скорость коррозии может быть также выражена по закону Фарадея через ток или плотность тока. Максимальная скорость коррозии определяется предельной плотностью iпр восстановления кислорода по уравнению: iпр=4FDo2co2δ-1, где Do2-коэффициент диф., co2-концентрация кислорода в р-ре, δ – толщина диффузионного слоя. Скорость коррозии с кислородной деполяризацией растет с увеличением коэффициента диффузии, растворимости кислорода и перемешивании р-ра. Скорость катодного выделения водорода возрастает с увеличением температуры и концентрации ионов водорода (снижение рН). На скорость этого процесса заметно влияет природа катодных участков.
29.Токи , ответвляющиеся от своего основного пути, называются блуждающими. Источниками блуждающих токов могут быть различные системы и у-ва, работающие на постоянном токе, например жд пути электропоездов, трамвайные линии, заземления постоянного тока, установки для электросварки, электролизные ванны, системы катодной защиты.
Коррозия Ме под влиянием электрического тока от внешнего источника наз. электрокоррозией. В кач-ве примера коррозии блуждающими токами можно растмореть электрокоррозию подземного трубопровода во влажной почве. Так же коррозию б.т. может например вызвать установленный на берегу дизель-генератор для сварки, соединенный заземленными проводами пост тока с находящимся в ремонте кораблем.
30.Защита от коррозии.1)Создание на поверхности защитной пленки. В качестве покрытий используются неметаллические, в частности органические, материалы например пленки высокополимерных веществ(каучук, пластмассы), лаки, олифа; особое значение имеют пленки из оксидов металлов, получаемые при действии кислорода или подходящих окислителей(азотная кислота) на поверхность металлов. 2)Электрохимические методы защиты - методы основаны на изменении потенциала защищаемого металла и не связаны с изоляцией металла от коррозионной среды. К ним относятся катодная защита, называемая также электрозащитой, и протекторная (анодная) защита. Катодная защита заключается в том, что защищаемая конструкция, находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду внешнего источника электричества. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла (рельс), присоединяемый к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается. Протекторная защита -отличается от катодной защиты тем, что для ее осуществления используется специальный анод -протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции(Al). Протектор соединяют с защищаемой конструкцией поводником электрического тока. В процессе коррозии протектор служит анодом и разрушается, тем самым предохраняя от разрушения защищаемою конструкцию.
