Тема 9. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
1. Приведены определения способов выражения концентрации растворов:
1) количество растворенного вещества (моль) в одном литре раствора
2) количество растворенного вещества (моль) в одном кг растворителя
3) количество эквивалентов растворенного вещества (моль-эк) в одном литре раствора
4) отношение массы растворенного вещества к массе раствора
5) масса растворенного вещестав (г) в одном мл раствора
6) отношение количества растворенного вещества к общему количеству компонентов раствора
Укажите определение
| молярной концентрации раствора | |
| моляльности раствора |
2. Приведены определения способов выражения концентрации растворов
1) количество растворенного вещества (моль) в одном литре раствора
2) количество растворенного вещества (моль) в одном кг растворителя
3) количество эквивалентов растворенного вещества (моль-эк) в одном литре раствора
4) отношение массы растворенного вещества к массе раствора
5) масса растворенного вещестав (г) в одном мл раствора
6) отношение количества растворенного вещества к общему количеству компонентов раствора
Укажите определение
| эквивалентной концентрации раствора | |
| титра раствора |
3. Приведены определения способов выражения концентрации растворов
1) количество растворенного вещества (моль) в одном литре раствора
2) количество растворенного вещества (моль) в одном кг растворителя
3) количество эквивалентов растворенного вещества (моль-эк) в одном литре раствора
4) отношение массы растворенного вещества к массе раствора
5) масса растворенного вещестав (г) в одном мл раствора
6) отношение количества растворенного вещества к общему количеству компонентов раствора
Укажите определение
| массовой доли растворенного вещества | |
| мольной доли раствора |
4. Установите соответствие между определением и обозначением способа выражения концентрации раствора:
| Определение | Обозначение | |||||||
| А) | Количество растворённого вещества в одном килограмме растворителя | 1) | СМ | |||||
| Б) | Количество растворённого вещества в одном литре раствора | 2) | Сэк | |||||
| В) | Количество эквивалентов растворённого вещества в одном литре раствора | 3) | Т | |||||
| Г) | Отношение массы растворенного вещества к массе раствора | 4) | Cm | |||||
| Д) | Масса растворенного вещества (г) в 1 мл раствора | 5) | NA | |||||
| Е) | Отношение количества растворённого вещества к сумме количества всех компонентов раствора | 6) | ω | |||||
| А | Б | В | Г | Д | Е | |||
5. Установите соответствие между названием и обозначением способа выражения концентрации раствора:
| Название | Обозначение | ||||||
| А) | Массовая доля растворённого вещества | 1) | Т | ||||
| Б) | Молярная концентрация | 2) | NA | ||||
| В) | Молярная концентрация эквивалента | 3) | Cm | ||||
| Г) | Моляльность | 4) | CM | ||||
| Д) | Титр | 5) | ω | ||||
| Е) | Мольная доля растворённого вещества | 6) | СЭК | ||||
| А | Б | В | Г | Д | Е | ||
6. Приведены правые части формул, соответствующие различным способам выражения концентрации растворов
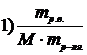
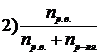
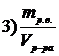
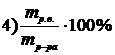
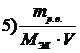
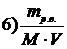
Укажите формулу, соответствующую
| массовой доле растворено говещества | |
| молярной концентрации раствора |
7. Приведены правые части формул, соответствующие различным способам выражения концентрации растворов
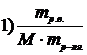
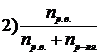
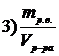
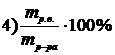
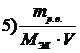
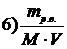
Укажите формулу, соответствующую
| мольной доле растворенного вещества | |
| эквивалентной концентрации раствора |
8. Приведены правые части формул, соответствующие различным способам выражения концентрации растворов
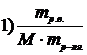
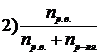
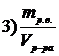
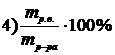
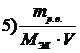
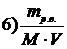
Укажите формулу, соответствующую
| моляльности раствора | |
| титру раствора |
9. В растворе серной кислоты объемом 0,5 л содержится 196 г H2SO4. Плотность раствора
1,225 г/мл. Вычислите
| молярную концентрацию раствора | |
| массовую долю H2SO4 в растворе (%) |
10. В растворе сульфата меди (II), эквивалентная концентрация которого равна 0,1 н, содержится 8 г CuSO4. Вычислите
| объем раствора (мл) | |
| молярную концентрацию раствора | 0,05 |
11. Масса раствора этанола С2Н5ОН равна 5 кг. Моляльность раствора - 2,5 моль/кг Н2О. Вычислите
| массу спирта в растворе (г) | |
| мольную долю спирта в растворе | 0,043 |
12. Раствор содержит 100 г Н3РО4 в 100 моль воды. Вычислите
| массовую долю кислоты в растворе (%) | |
| её мольную долю | 0,154 |
13. Растворением в воде сульфата алюминия приготовили 2 л раствора этой соли с молярной концентрацией 1 М. Вычислите
| массу растворенной соли (г) | |
| эквивалентную концентрацию раствора |
14. Растворением в воде газообразного аммиака приготовлен 1 л нашатырного спирта с молярной концентрацией 18 М и плотностью 0,9 г/мл. Вычислите
| объем (л) израсходованного аммиака, измеренный при н.у. | 403,2 |
| массовую долю NH3 в растворе (%) |
15. В 5 л воды растворено 460 г глицерина C3H5(OH)3. Вычислите
| моляльность раствора | |
| массовую долю глицерина в растворе (%) | 8,42 |
16. Раствор нитрата натрия объёмом 300 мл с молярной концентрацией 0,2 М (r = 1,005 г/мл) приготовили путём растворения соли в воде. Определите
| массу NaNO3 (г) | 5,1 |
| моляльность полученного раствора | 0,2 |
17. Приготовлен 8%-й раствор сульфита натрия объёмом 5 л (ρ = 1,075 г/мл) путём растворения соли в воде. Определите
| массу взятого Na2SO3 (г) | |
| мольную долю Na2SO3 в растворе (%) | 1,22 |
18. Газообразный хлороводород объёмом 67,2 л (н.у.) растворили в воде и получили 9%-й раствор соляной кислоты (r = 1,04 г/мл). Определите
| объём использованной воды (мл) | 1107,2 |
| эквивалентную концентрацию полученного раствора | 2,56 |
19. Из 75 мл 0,75 н раствора ортофосфорной кислоты путём разбавления водой приготовили децимолярный раствор. Определите
| объем полученного раствора Н3РО4 (мл) | 187,5 |
| его титр (г/мл) | 0,0098 |
20. К 450 мл пятимолярного раствора серной кислоты прилили 150 мл воды; получили раствор с плотностью 1,220 г/мл. Для полученного раствора вычислите
| массовую долю H2SO4 (%) | 30,1 |
| эквивалентную концентрацию | 7,5 |
21. К 450 мл 0,4 н раствора ортофосфорной кислоты прилили 100 мл воды; получили раствор с плотностью 1,005 г/мл. Для полученного раствора вычислите
| массовую долю H3PO4 (%) | |
| молярную концентрацию | 0,1 |
22. К 150 мл двумолярного раствора серной кислоты прилили 50 мл воды; получили раствор с плотностью 1,090 г/мл. Для полученного раствора вычислите
| массовую долю H2SO4 (%) | 13,5 |
| эквивалентную концентрацию |
23. К 300 г 20%-го раствора хлорида натрия прилили 400 мл воды; получили раствор с плотностью 1,063 г/мл. Для полученного раствора вычислите
| массовую долю NaCl (%) | 8,6 |
| молярную концентрацию | 1,56 |
24. К 50 мл 2 М раствора серной кислоты прилили 150 мл воды; получили раствор с плотностью
1,030 г/мл. Для полученного раствора вычислите
| массовую долю H2SO4 (%) | 4,76 |
| молярную концентрацию | 0,5 |
25. К 400 мл воды прилили 100 мл 96%-й серной кислоты (ρ = 1,84 г/мл). Плотность полученного раствора 1,22 г/мл. Определите
| эквивалентную концентрацию полученного раствора | 7,2 |
| массовую долю Н2SO4 (%) | 30,2 |
26. Из 2 М раствора серной кислоты приготовлено 400 мл 0,1 н раствора. Определите
| объем израсходованного раствора (мл) | |
| титр полученного раствора | 0,0049 |
27. К 900 мл воды прибавили 100 мл 60%-й серной кислоты плотностью 1,5 г/мл. Для полученного раствора определите
| массовую долю H2SO4 (%) | 8,6 |
| мольную долю | 0,017 |
28. Из 400 г 10%-го раствора сульфата натрия выпарили 250 мл воды и получили раствор с плотностью 1,22 г/мл. Для полученного раствора вычислите
| массовую долю Na2SO4 (%) | 26,7 |
| эквивалентную концентрацию | 4,6 |
29. Из 500 г 12%-го раствора нитрата натрия выпарили 200 мл воды и получили раствор с плотностью 1,14 г/мл. Для полученного раствора вычислите
| массовую долю NaNO3 (%) | |
| эквивалентную концентрацию | 2,68 |
30. Из 330 г раствора хлорида натрия с массовой долей 14 % (ρ = 1,1 г/мл) выпарили 50 мл воды. Вычислите
| массовую долю NaСl в полученном растворе (%) | 16,5 |
| титр полученного раствора | 0,185 |
31. Из 500 г 10%-го раствора сульфата натрия выпарили 150 мл воды и получили раствор с плотностью 1,13 г/мл. Для полученного раствора вычислите
| массовую долю Na2SO4 (%) | 14,3 |
| эквивалентную концентрацию | 2,28 |
32. Из 200 г 15%-го раствора хлорида натрия выпарили 50 мл воды. Для полученного раствора, плотность которого 1,17 г/мл, определите
| массовую долю NaCl (%) | |
| титр полученного раствора | 0,235 |
33. Из 600 г 20%-го раствора нитрата натрия выпарили 200 мл воды и получили раствор с плотностью 1,22 г/мл. Для полученного раствора вычислите
| массовую долю NaNO3 (%) | |
| эквивалентную концентрацию | 4,3 |
34. К 200 г 20%-го раствора хлорида натрия прилили 400 г 5%-го раствора той же соли; получили раствор с плотностью 1,071 г/мл. Для полученного раствора вычислите
| массовую долю NaCl (%) | |
| молярную концентрацию | 1,83 |
35. К 300 г 10%-го раствора хлорида натрия прилили 200 г 5%-го раствора той же соли и получили раствор с плотностью 1,06 г/мл. Для полученного раствора вычислите
| массовую долю NaCl (%) | |
| эквивалентную концентрацию | 1,44 |
36. Смешали 200 г 30%-й азотной кислоты с 300 г 20%-го раствора этой же кислоты. Вычислите
| моляльность полученного раствора | |
| массовую долю HNO3 в полученном растворе (%) |
37. К 250 г 10%-го раствора хлорида натрия прилили 200 г 5%-го раствора той же соли и получили раствор с плотностью 1,06 г/мл. Для полученного раствора вычислите
| массовую долю NaCl (%) | 7,8 |
| эквивалентную концентрацию | 1,4 |
38. К одному кг 50%-го раствора гидроксида калия прибавили некоторую массу 20%-го раствора той же щёлочи и получили 25%-й раствор. Определите
| массу исходного раствора КОН (кг) | |
| моляльность полученного раствора |
39. К 300 г 25%-го раствора гидроксида натрия добавили 400 г 40%-го раствора той же щёлочи. Для полученного раствора определите
| массовую долю NaОН (%) | 33,6 |
| мольную долю NaОН | 0,185 |
40. Раствор объёмом 500 мл, содержащий 14 г гидроксида калия, нейтрализовали 2 М соляной кислотой. Определите
| объем соляной кислоты (мл) | |
| эквивалентную концентрацию раствора щёлочи | 0,5 |
41. Некоторый объем серной кислоты с молярной концентрацией 2 М провзаимодействовал с 650 мл 20%-го раствора карбоната калия плотностью 1,19 г/мл. Вычислите
| объем 2 М серной кислоты (мл) | |
| объем (н.у.) выделившегося СО2 (л) |
42. В 5 н раствор соляной кислоты внесли карбонат кальция. В ходе реакции выделилось 58 л СО2 при 22 °С и 98 кПа. Определите
| объем раствора кислоты (мл) | |
| массу карбоната кальция (г) | 231,7 |
43. В 10 н раствор хлорида аммония внесли навеску гидроксид калия и получили 112 л NH3 при 18 °С и 98 кПа. Определите
| объем раствора NH4Cl (мл) | |
| массу КОН (г) |
44. Нейтрализацию раствора, содержащего 16 г NaОН, проводили 10%-м раствором серной кислоты с плотностью 1,07 г/мл. Определите
| объем раствора Н2SO4 (мл) | 183,2 |
| титр этого раствора | 0,107 |
45. Для нейтрализации 10 мл раствора HCl потребовалось 50 мл раствора NaOH, титр которого равен 0,02 г/мл. Определите молярную концентрацию эквивалента раствора
| гидроксида натрия | 0,5 |
| соляной кислоты | 2,5 |
46. Для нейтрализации 20 мл серной кислоты потребовалось 50 мл раствора гидроксида натрия, титр которого равен 0,01 г/мл. Определите
| титр раствора серной кислоты | 0,03 |
| молярную концентрацию раствора NaOH | 0,25 |
47. Для нейтрализации 50 мл азотной кислоты потребовалось 50 мл раствора гидроксида натрия, титр которого равен 0,01 г/мл. Определите для раствора азотной кислоты
| титр | 0,016 |
| молярную концентрацию | 0,25 |
48. Коэффициент растворимости хлорида аммония при 0 °С и 100 °С равен 29,4 и 78,6. Вычислите массу NH4Cl (г), которая
| растворяется в 5 л воды при 100 °С | |
| кристаллизуется при охлаждении этого раствора до 0 °С |
49. Массовая доля раствора хлорида натрия при 80 °С равна 27,6 %. Коэффициент растворимости NaCl при 0 °С равен 35,7. Определите
| коэффициент растворимости NaCl при 80 °С | 38,1 |
| массу NaCl, выпавшего в осадок при охлаждении 300 г раствора с 80 до 0 °С (г) | 3,9 |
50. Коэффициент растворимости хлорида калия при 0 °С и 60 °С равен 28,0 и 45,8. Определите
| массу КCl, выпавшего в осадок при охлаждении 400 г раствора с 60 до 0 °С (г) | 38,2 |
| массовую долю КCl в образовавшемся растворе (%) | 21,9 |
Тема 10. ОБРАЗОВАНИЕ И СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ И ЭЛЕКТРОЛИТОВ
1. В 100 мл воды растворено 8 г нитрата аммония. Энтальпия растворения этой соли равна
25 кДж/моль, удельная теплоёмкость полученного раствора 4,2 Дж/(г∙К). Определите
| на сколько градусов понизилась температура раствора | 5,5 |
| как изменяется энтропия в процессе растворения (1 – увеличивается, 2 – уменьшается, 3 – не изменяется) |
2. В 100 мл воды растворено 11,7 г хлорида натрия. Энтальпия растворения этой соли равна
5 кДж/моль, удельная теплоёмкость полученного раствора 4,2 Дж/(г∙К). Определите
| на сколько градусов понизилась температура раствора | 2,13 |
| как изменяется энергия Гиббса в процессе растворения (1 – увеличивается, 2 – уменьшается, 3 – не изменяется) |
3. В 200 мл воды растворено 16 г гидроксида натрия. Энтальпия растворения гидроксида натрия равна –42 кДж/моль, удельная теплоёмкость полученного раствора равна 4,2 Дж/(г∙К). Определите
| на сколько градусов повысилась температура раствора | 18,5 |
| как изменяется энтропия в процессе растворения (1 – увеличивается, 2 – уменьшается, 3 – не изменяется) |
4. В 200 мл воды растворено 22,2 г хлорида кальция. Энтальпия растворения этой соли равна
–76,8 кДж/моль, удельная теплоёмкость полученного раствора равна 4,2 Дж/(г∙К). Определите
| на сколько градусов повысилась температура раствора | 16,46 |
| как изменяется энергия Гиббса в процессе растворения (1 – увеличивается, 2 – уменьшается, 3 – не изменяется) |
5. При растворении 8,5 г нитрата натрия в 100 мл воды температура понизилась на 4,7°. Теплоёмкость полученного раствора равна 4,1 кДж/(г∙К). Определите
| энтальпию растворения NaNO3 (кДж/моль) | 20,9 |
| как изменяется энтропия в процессе растворения (1 – увеличивается, 2 – уменьшается, 3 – не изменяется) |
6. В 100 г воды растворили 4,6 г глицерина С3Н5(ОН)3. Эбуллиоскопическая константа воды 0,516, давление насыщенного пара воды при 20 °С равно 2337 Па. Вычислите
| повышение температуры кипения раствора (°С) | 0,26 |
| давление пара над раствором при 20 °С (Па) |
7. Приготовлен 50%-й водный раствор этанола С2Н5ОН. Криоскопическая константа воды 1,858. Вычислите
| моляльность раствора | 21,74 |
| температуру кристаллизации раствора (°С) | –40,4 |
8. Приготовлен 12,5%-й водный раствор глицерина С3Н5(ОН)3. Криоскопическая константа воды 1,858. Вычислите
| моляльность раствора | 1,55 |
| температуру кристаллизации раствора (°С) | –2,88 |
9. В 3 л воды растворили этиленгликоль С2Н4(ОН)2. Раствор кристаллизуется при –3,5 °С. Эбуллиоскопическая константа воды равна 0,516. Вычислите
| массовую долю этиленгликоля в растворе (%) | 10,48 |
| повышение температуры кипения раствора (°С) | 0,97 |
10. Этиленгликоль С2Н4(ОН)2 массой 500 г растворили в одном литре воды. Эбуллиоскопическая и криоскопическая константа воды 0,516 и 1,858, соответственно. Для полученного раствора вычислите изменение температур
| кипения | 4,16 |
| кристаллизации | 14,98 |
11. Плотность 12%-го раствора глюкозы С6Н12О6 при 25 °С равна 1046 г/л. Давление насыщенного пара воды при данной температуре 3170 Па. Вычислите
| осмотическое давление раствора (кПа) | |
| давление пара над раствором (Па) |
12. Расположите одинаковые по концентрации растворы веществ
1) метанол СН3ОН 2) этанол С2Н5ОН
3) этиленгликоль С2Н4(ОН)2 4) глицерин С3Н5(ОН)3
в порядке уменьшения
| температуры кипения | |
| давления пара растворителя над раствором |
13. Расположите одинаковые по концентрации растворы веществ
1) метанол СН3ОН 2) этанол С2Н5ОН
3) этиленгликоль С2Н4(ОН)2 4) глицерин С3Н5(ОН)3
в порядке увеличения
| температуры кипения | |
| давления пара растворителя над раствором |
14. Расположите одинаковые по концентрации растворы веществ
1) этиленгликоль С2Н4(ОН)2 2) этанол С2Н5ОН
3) глицерин С3Н5(ОН)3 4) глюкоза С6Н12О6
в порядке увеличения
| температуры кристаллизации | |
| давления пара растворителя над раствором |
15. В одном килограмме бензола растворили 503 г неизвестного вещества. Полученный раствор (неэлектролит) закипает при температуре на 9,3° выше, чем чистый бензол. Эбуллиоскопическая и криоскопическая константы бензола 2,57 и 5,70. Вычислите
| молекулярную массу растворенного вещества | |
| понижение температуры кристаллизации раствора | 20,63 |
16. В 200 мл воды растворено 22,5 г неэлектролита. Раствор закипает при 100,645 °С. Эбуллиоскопическая и криоскопическая константы воды равны 0,516 и 1,858. Вычислите
| молекулярную массу неэлектролита | |
| температуру кристаллизации раствора (°С) | –2,32 |
17. При растворении 6,0 г неэлектролита в 0,5 л воды был получен раствор, замерзающий при температуре –0,373 °С. Эбуллиоскопическая и криоскопическая константы воды равны 0,516 и 1,858. Вычислите
| молекулярную массу неэлектролита | |
| повышение температуры кипения раствора (°С) | 0,1 |
18. В 1000 г бензола растворено 8,1 г серы. Эбуллиоскопическая константа бензола 2,57. Раствор кипит на 0,081° выше, чем чистый бензол. Вычислите
| массовую долю серы в растворе (%) | 0,803 |
| число атомов в молекуле серы |
19. При полной диссоциации 0,1 моль сульфата железа (III) в водном растворе образуется количество (моль)
| катионов | 0,2 |
| анионов | 0,3 |
20. В 5 л одномолярного раствора сульфата алюминия содержится количество (моль)
| катионов | |
| анионов |
21. При полной диссоциации 10 г хлорида кальция в растворе содержится количество (моль)
| катионов | 0,09 |
| анионов | 0,18 |
22. При полной диссоциации 10 г сульфата железа (III) в водном растворе образуется количество (моль)
| катионов | 0,05 |
| анионов | 0,075 |
23. Установите последовательность расположения ионов, образующихся при электролитической диссоциации ортофосфорной кислоты, по увеличению их концентрации
А) Н+ Б) НРО42– В) РО43– Г) Н2РО4–
| А | Б | В | Г | |
24. Установите последовательность расположения ионов, образующихся при электролитической диссоциации дигидрофосфата натрия, по увеличению их концентрации
А) Н+ Б) НРО42– В) РО43– Г) Н2РО4– Д) Na+
| А | Б | В | Г | Д | |
25. Установите последовательность расположения ионов, образующихся при электролитической диссоциации хлорида дигидроксоалюминия, по увеличению их концентрации
А) Al(ОH)2+ Б) AlOH2+ В) Cl– Г) OH– Д) Al3+
| А | Б | В | Г | Д | |
26. Укажите процесс электролитической диссоциации
1) HNO2 D H+ + NO2− 2) ZnOHCl D Zn2+ + OHCl2−
3) HSO4− D H+ + SO42− 4) NaHCO3 D Na+ + HCO3−
| протекающий необратимо | |
| схема которого записана неверно |
27. Укажите процесс электролитической диссоциации
1) H2SO3 D 2H+ + SO32− 2) AlOHCl2 D Al3+ + OHCl23−
3) HCO3− D H+ + CO32− 4) NaHS D Na+ + HS−
| протекающий необратимо | |
| схема которого записана неверно |
28. Приведена схема электролитической диссоциации азотистой кислоты
HNO2 D H+ + NO2−
и выражения для константы диссоциации
1) 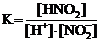 2)
2) 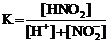 3)
3) 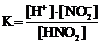 4)
4) 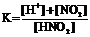
Укажите
| правильное выражение для константы диссоциации | ||
| влияние разбавления раствора на её значение (1 – увеличивается, 2 – уменьшается, 3 – не изменяется) | ||
29. Приведена схема электролитической диссоциации гидроксида аммония
NH4OH D NH4+ + OH−
и выражения для константы диссоциации
1) 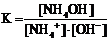 2)
2) 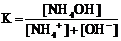 3)
3) 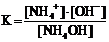 4)
4) 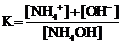
Укажите
| правильное выражение для константы диссоциации | |
| влияние разбавления раствора на её значение (1 – увеличивается, 2 – уменьшается, 3 – не изменяется) |
30. Приведена схема электролитической диссоциации уксусной кислоты
СН3СООН D Н+ + СН3СОО–
Укажите влияние разбавления раствора (1 – увеличивается, 2 – уменьшается, 3– не изменяется)
на значение
| константы диссоциации | |
| степени диссоциации |
31. Приведена схема электролитической диссоциации циановодородной кислоты
НСN D Н+ + СN–
Укажите влияние разбавления раствора (1 – увеличивается, 2 – уменьшается, 3– не изменяется)
на значение
| константы диссоциации | |
| степени диссоциации |
32. Установите соответствие между веществом и его свойством в водном растворе
| Вещество | Свойство | ||
| А) | HCl | 1) | Неэлектролит |
| Б) | HClO4 | 2) | Слабый электролит |
| В) | H2S | 3) | Сильный электролит |
| Г) | NH3 | ||
| Д) | O2 |
| А | Б | В | Г | Д | |
33. Установите соответствие между веществом и его свойством в водном растворе
| Вещество | Свойство | ||
| А) | HNO2 | 1) | Неэлектролит |
| Б) | CH3COOH | 2) | Слабый электролит |
| В) | KOH | 3) | Сильный электролит |
| Г) | C2H5OH | ||
| Д) | NaCl |
| А | Б | В | Г | Д | |
34. Установите соответствие между веществом и его свойством в водном растворе
| Вещество | Свойство | ||
| А) | Серная кислота | 1) | Неэлектролит |
| Б) | Сульфат аммония | 2) | Слабый электролит |
| В) | Сахароза | 3) | Сильный электролит |
| Г) | Азотистая кислота | ||
| Д) | Фтороводородная кислота |
| А | Б | В | Г | Д | |
35. Установите соответствие между веществом и его свойством в водном растворе
| Вещество | Свойство | ||
| А) | Сернистая кислота | 1) | Неэлектролит |
| Б) | Метанол | 2) | Слабый электролит |
| В) | Азотная кислота | 3) | Сильный электролит |
| Г) | Карбонат калия | ||
| Д) | Аммиак |
| А | Б | В | Г | Д | |
36. Константа диссоциации гидроксида аммония равна 1,76∙10–5, концентрация его раствора 0,01 М. Вычислите
| степень электролитической диссоциации NH4OH (%) | 4,2 |
| водородный показатель раствора | 10,62 |
37. Константа диссоциации уксусной кислоты равна 1,74∙10–5, концентрация её раствора 0,01 М. Вычислите
| степень электролитической диссоциации кислоты (%) | 4,17 |
| водородный показатель раствора | 3,38 |
38. Константа диссоциации хлорноватистой кислоты равна 3,0∙10–8, концентрация её раствора 0,01 М. Вычислите
| степень электролитической диссоциации кислоты (%) | 0,173 |
| водородный показатель раствора | 4,77 |
39. Константа диссоциации циановодородной кислоты равна 5,0∙10–10, концентрация её раствора 0,01 М. Вычислите
| степень электролитической диссоциации кислоты (%) | 0,022 |
| водородный показатель раствора | 5,66 |
40. Константа диссоциации азотистой кислоты равна 6,9∙10–4, концентрация её раствора 0,01 М. Вычислите
| степень электролитической диссоциации кислоты (%) | 26,3 |
| водородный показатель раствора | 2,6 |
41. Вычислите водородный показатель (рН) 0,005 М растворов
| азотной кислоты | 2,3 |
| гидроксида бария |
42. Вычислите водородный показатель (рН) 0,002 М растворов
| соляной кислоты | 2,7 |
| гидроксида кальция | 11,6 |
43. Вычислите водородный показатель (рН) 0,001 М растворов
| серной кислоты | 2,7 |
| гидроксида натрия |
44. Вычислите водородный показатель (рН) 1%-х растворов
| азотной кислоты | 0,8 |
| гидроксида калия | 13,25 |
45. Вычислите водородный показатель (рН) 0,5%-х растворов
| соляной кислоты | 0,86 |
| гидроксида натрия | 13,1 |
46. Произведение растворимости сульфата бария равно 1,1∙10–10. Вычислите
| молярную концентрацию BaSO4 в насыщенном растворе | 1∙10–5 |
| в каком объеме воды (л) растворяется 1 г BaSO4 | 409,2 |
47. Произведение растворимости ортофосфата железа (III) равно 1,3∙10–22. Вычислите
| молярную концентрацию FePO4 в насыщенном растворе | 1,14∙10–11 |
| в каком объеме воды (л) растворяется 1,51 г FePO4 | 8,77∙108 |
48. Произведение растворимости хлорида серебра равно 1,8∙10–10. Вычислите
| молярную концентрацию анионов в насыщенном растворе AgCl | 1,34∙10–5 |
| в каком объеме воды (л) растворяется 1,445 г AgCl | 752,6 |
49. Произведение растворимости ортофосфата железа (III) равно 1,3∙10–22. Для насыщенного раствора вычислите
| молярную концентрацию FePO4 | 1,14∙10–11 |
| массу ионов железа, содержащихся в 100 л раствора (г) | 6,4∙10–8 |
50. Произведение растворимости сульфата бария 1,1∙10–10. Для насыщенного раствора вычислите
| молярную концентрацию BaSO4 | 1∙10–5 |
| массу ионов бария, содержащихся в 20 л раствора (г) | 0,029 |
