Сопряжённые системы. ароматичность.
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ В БЕНЗОЛЕ
И ЕГО ПРОИЗВОДНЫХ
Сопряжение – это выравнивание связей и зарядов в реальной молекуле (или частице) по сравнению с идеальной, но несуществующей структурой. Можно дать и другое определение этому явлению: это процесс дополнительного взаимодействия
p-электронных орбиталей, приводящий к делокализации электронной плотности.
Рассмотрим пример сопряжённой системы – молекулу бутадиена-1,3.
CH2=CH-CH=CH2
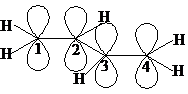 Атомы углерода в молекуле бутадиена-1,3 sp2-гибридизованы. Это значит, что все σ-связи расположены в одной плоскости под углом 120о. p-Электронная орбиталь каждого атома углерода расположена перпендикулярно плоскости σ-связей. Вы уже знаете, что за счёт бокового перекрывания p-орбиталей образуются π-связи. В соответствии с формулой бутадиена-1,3 мы можем предположить, что одна π-связь образуется за счёт перекрывания р-орбиталей С-1 и С-2, а вторая – С-3 и С-4. Но посмотрите на приведенный выше рисунок: почему р-орбитали С-2 и С-3 не смогут перекрыться? Действительно, происходит их дополнительное перекрывание, и на самом деле в молекуле бутадиена-1,3 не существует двух отдельных областей с повышенной электронной плотностью (две π-связи), а образуется общее электронное облако, содержащее 4 электрона и принадлежащее четырём атомам углерода. Поэтому реальную структуру бутадиена-1,3 можно изобразить следующим образом:
Атомы углерода в молекуле бутадиена-1,3 sp2-гибридизованы. Это значит, что все σ-связи расположены в одной плоскости под углом 120о. p-Электронная орбиталь каждого атома углерода расположена перпендикулярно плоскости σ-связей. Вы уже знаете, что за счёт бокового перекрывания p-орбиталей образуются π-связи. В соответствии с формулой бутадиена-1,3 мы можем предположить, что одна π-связь образуется за счёт перекрывания р-орбиталей С-1 и С-2, а вторая – С-3 и С-4. Но посмотрите на приведенный выше рисунок: почему р-орбитали С-2 и С-3 не смогут перекрыться? Действительно, происходит их дополнительное перекрывание, и на самом деле в молекуле бутадиена-1,3 не существует двух отдельных областей с повышенной электронной плотностью (две π-связи), а образуется общее электронное облако, содержащее 4 электрона и принадлежащее четырём атомам углерода. Поэтому реальную структуру бутадиена-1,3 можно изобразить следующим образом:

Все углерод-углеродные связи в молекуле выравнены и в ней практически нет одинарных и двойных связей, а есть общее делокализованное электронное облако. Это и есть выравнивание связей в реальной молекуле по сравнению с идеальной, но несуществующей, строение которой мы записали как
CH2=CH-CH=CH2 .
Сопряжение – это энергетически выгодный для молекулы процесс. Вы знаете, что при образовании связи (т.е. при взаимодействии атомных орбиталей) выделяется энергия, значит, внутренняя энергия системы понижается, и она становится более стабильной. Так как при сопряжении происходит дополнительное перекрывание орбиталей, то выделяется и дополнительная энергия, и система становится ещё более стабильной. Энергия, выделяющаяся в результате сопряжения, называется энергией сопряжения. Количественно – это разность энергий соединения с сопряжёнными двойными связями и соединения с изолированными двойными связями (где сопряжение невозможно). Для бутадиена-1,3 она составляет 15 кДж/моль. Чем больше атомов участвует в сопряжении, тем выше энергия сопряжения, тем стабильнее молекула. Поэтому в природе распространены соединения, молекулы которых содержат длинные сопряжённые цепи (например, каротиноиды, см. стр. 232).
Бутадиен-1,3 является примером π,π-сопряжённой системы, т.к. в сопряжении участвуют электроны π-связей. Признаком π,π-сопряжённой системы является чередование одинарных и двойных связей в молекуле.
Другим видом сопряжения является p,π-сопряжение. В
p,π-сопряжении участвуют электронные облака π-связей и
p-орбитали, причём на p-орбитали может находиться 1 электрон, неподелённая электронная пара или эта орбиталь может быть вакантной. Рассмотрим конкретные примеры.

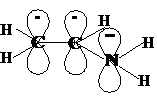 Это электронное строение молекулы виниламина CH2=CH-NH2 . Атомы углерода и азота sp2-гибридизованы, т.е. все σ-связи лежат в одной плоскости, а негибридные p-орбитали перпендикулярны этой плоскости. Происходит перекрывание всех трёх р-орбиталей с образованием делокализованного электронного облака; 4 электрона (т.к. у азота на негибридной орбитали неподелённая электронная пара) принадлежат трём атомам сопряжённой системы. На формуле виниламина это можно обозначить так:
Это электронное строение молекулы виниламина CH2=CH-NH2 . Атомы углерода и азота sp2-гибридизованы, т.е. все σ-связи лежат в одной плоскости, а негибридные p-орбитали перпендикулярны этой плоскости. Происходит перекрывание всех трёх р-орбиталей с образованием делокализованного электронного облака; 4 электрона (т.к. у азота на негибридной орбитали неподелённая электронная пара) принадлежат трём атомам сопряжённой системы. На формуле виниламина это можно обозначить так:
Количество электронов, делокализованных в
р,π-сопряжённой системе, не всегда совпадает с количеством атомов, принимающих участие в сопряжении, например:
 |
Признаком р,π-сопряжённой системы является
sp2-гибридизация атомов, т.е. если в молекуле есть фрагмент, в котором три или более атомов подряд sp2-гибридизованы – этот фрагмент является р,π-сопряжёной системой.
 Во всех сопряжённых системах, которые мы рассмотрели, можно выделить начало и конец, поэтому их называют открытыми сопряжёнными системами. А теперь рассмотрим так называемые замкнутые сопряжённые системы. Примером является молекула бензола.
Во всех сопряжённых системах, которые мы рассмотрели, можно выделить начало и конец, поэтому их называют открытыми сопряжёнными системами. А теперь рассмотрим так называемые замкнутые сопряжённые системы. Примером является молекула бензола.
Формула Кекуле показывает, что бензол – это ненасыщенный углеводород, в молекуле которого есть три π-связи.
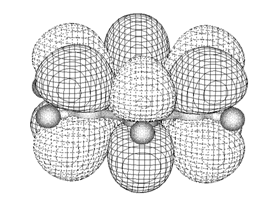
Если же мы рассмотрим электронное строение бензола, то увидим, что это π.π-сопряжённая система (атомы углерода sp2-гибридизованы, все σ-связи лежат в одной плоскости, а p-орбитали расположены перпендикулярно этой плоскости и перекрываются не попарно, а образуя общее электронное облако, в котором делокализовано 6 электронов).
 | |||
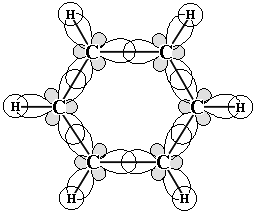 | |||
 Над и под плоскостью цикла располагаются электронные облака, так называемые «электронные бублики». Чтобы выразить это, используют другую формулу бензола:
Над и под плоскостью цикла располагаются электронные облака, так называемые «электронные бублики». Чтобы выразить это, используют другую формулу бензола:
Длины С-С-связей в бензоле выравнены и равны 0,140 нм (сравните: длина одинарной С-С-связи – 0,154 нм, двойной С=С-связи – 0,134 нм).
Замкнутые сопряжённые системы более стабильны, чем открытые, т.к. энергия сопряжения замкнутых сопряжённых систем выше (в случае бензола – это 151 кДж/моль).
Бензол называют ароматическим соединением. Ароматичность – это совокупность свойств замкнутых сопряжённых систем, проявляющаяся в их высокой устойчивости к реакциям присоединения и окисления.
Ароматическими свойствами обладает не только бензол. Соединения, даже абсолютно не похожие по строению на бензол, также могут быть ароматическими, если они удовлетворяют квантово-механическим критериям ароматичности. Эти критерии следующие:
1. Наличие плоского цикла (все атомы цикла должны быть sp2-гибридизованы).
2. Наличие замкнутой сопряжённой системы (все атомы должны участвовать в сопряжении).
3. Выполнение правила Хюккеля. Число делокализованных электронов должно быть равно (4n+2), где n – это любое целое число.
(Например, в случае бензола 4n+2=6, n=1).
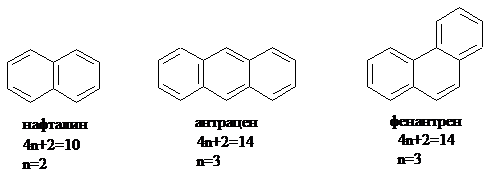 Ароматическими являются, например, нафталин, антрацен, фенантрен:
Ароматическими являются, например, нафталин, антрацен, фенантрен:
Химические свойства бензола
Бензол является ненасыщенным соединением, но мы выяснили, что в его структуре нет двойных связей, а есть ароматическая связь – делокализованное электронное облако. Типичные реакции непредельных углеводородов – электрофильное присоединение и окисление – для бензола не характерны. Так, он не обесцвечивает бромную воду, не даёт реакции Вагнера (окисление раствором перманганата калия при комнатной температуре). Для бензола характерны реакции, не приводящие к нарушению замкнутой сопряжённой системы, – реакции замещения. Чтобы выяснить, какой тип замещения (радикальное, электрофильное, нуклеофильное) характерен для бензола, вспомните его электронное строение: σ-скелет молекулы плоский, а над и под плоскостью расположено ароматическое облако. Чтобы провзаимодействовать с этим ароматическим облаком, реагент должен быть электрофильным. Итак, для бензола (и ароматических соединений вообще) характерны реакции электрофильного замещения. Примерами реакций SE являются:
 |
Рассмотрим общий механизм реакций электрофильного замещения в бензоле.
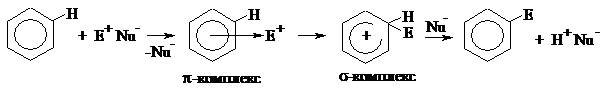 |
На первой стадии электрофил подходит к молекуле бензола и взаимодействует со всем ароматическим облаком (они притягиваются друг к другу). Образуется π-комплекс. Для образования новой ковалентной связи углерод-электрофил необходима пара электронов. Электрофил вырывает её из ароматического облака, образуется σ-комплекс. Он не является замкнутой сопряжённой системой, т.к. атом углерода, образовавший новую σ-связь, перешёл в sp3-гибридизацию (он вышел из плоскости и больше не имеет негибридной pz-орбитали). Остальные пять атомов углерода продолжают участвовать в сопряжении, образуя общее электронное облако, в котором делокализовано четыре электрона (6-2=4), поэтому положительный заряд в σ-комплексе обозначается не на конкретном атоме углерода, а в центре разомкнутого кольца. Итак, σ-комплекс не является ароматической структурой. Для того чтобы вернуть ароматичность, ему необходимо отщепить протон водорода (H+). Его забирает оставшийся в реакционной среде нуклеофил (Nu-). Два электрона связи C-H возвращаются в ароматическое облако, атом углерода вновь становится
sp2-гибридизованным и может участвовать в сопряжении.
Лимитирующей стадией реакции электрофильного замещения является стадия образования σ-комплекса, т.к. при этом происходит потеря ароматичности, что требует затрат энергии.
Различные реакции электрофильного замещения в бензоле протекают по общему механизму и отличаются только стадией образования электрофильной частицы.
Реакция нитрования бензола протекает под действием смеси концентрированных азотной и серной кислот (схему реакции см. выше). Рассмотрим её механизм.
 |
На первой стадии реакции азотная кислота взаимодействует с серной. В данном случае азотная кислота выполняет роль основания, принимая протон от молекулы серной кислоты (по теории Бренстеда, кислота – это молекула или ион, отдающие протон, а основание – молекула или ион, принимающие протон водорода). Образуется протонированная азотная кислота, которая, отщепляя молекулу воды, превращается в катион нитрония, или нитроний-катион. Это и есть электрофильная частица. Таким образом, серная кислота выполняет роль катализатора, принимая участие в образовании электрофильного реагента. Вторая роль серной кислоты – это роль водоотнимающего средства. Воду необходимо отводить из сферы реакции, чтобы сместить её равновесие вправо.
После образования электрофила – катиона нитрония - реакция протекает по общему механизму, через образование π- и
σ-комплексов:
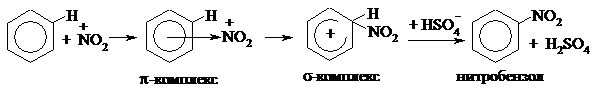 |
Обратите внимание: на стадии превращения σ-комплекса в нитробензол (стадии возвращения ароматичности) протон водорода отщепляется под действием аниона серной кислоты, при этом вновь образуется серная кислота, что доказывает, что она являлась катализатором данной реакции.
 Катализатором реакции галогенирования являются так называемые кислоты Льюиса (по теории Льюиса, кислоты – это нейтральные молекулы или ионы, способные принимать пару электронов): FeCl3, FeBr3, AlCl3, AlBr3 и т.п. Катализатор необходим, чтобы поляризовать молекулу галогена. Кислота Льюиса смещает на себя неподелённую электронную пару хлора, образуя комплекс, в котором на одном из атомов хлора сосредоточивается частичный положительный заряд:
Катализатором реакции галогенирования являются так называемые кислоты Льюиса (по теории Льюиса, кислоты – это нейтральные молекулы или ионы, способные принимать пару электронов): FeCl3, FeBr3, AlCl3, AlBr3 и т.п. Катализатор необходим, чтобы поляризовать молекулу галогена. Кислота Льюиса смещает на себя неподелённую электронную пару хлора, образуя комплекс, в котором на одном из атомов хлора сосредоточивается частичный положительный заряд:
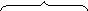 |
Далее молекула бензола взаимодействует с образовавшимся комлексом как с электрофилом:
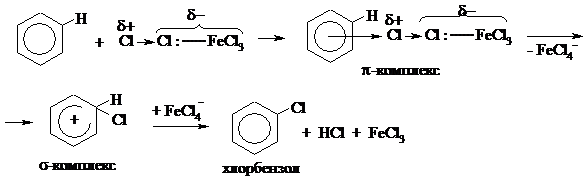 |
На стадии образования π-комплекса происходит дальнейшая поляризация связи Cl-Cl, и она разрывается гетеролитически, причём Cl+ сразу участвует в образовании σ-комплекса.
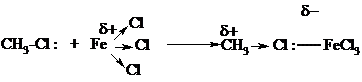 Аналогично протекают реакции алкилирования (реакция Фриделя-Крафтса).
Аналогично протекают реакции алкилирования (реакция Фриделя-Крафтса).
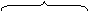 |
 |
Связь C-Cl в метилхлориде недостаточно полярна, чтобы разорваться гетеролитически. Под действием кислоты Льюиса увеличивается частичный положительный заряд на атоме углерода, и комплекс реагента с катализатором является более сильным электрофилом, чем исходный метилхлорид.
Реакция сульфирования бензола протекает под действием олеума (раствор серного ангидрида SO3 в концентрированной серной кислоте).
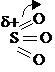 Молекула серного ангидрида является электрофилом из-за большого по величине частичного положительного заряда на атоме серы.
Молекула серного ангидрида является электрофилом из-за большого по величине частичного положительного заряда на атоме серы.
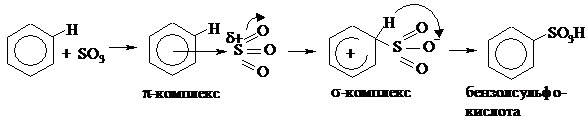 |
При образовании π-комплекса связь S=O (в первую очередь π-связь) поляризуется и разрывается по гетеролитическому типу, поэтому при образовании σ-комплекса на атоме кислорода возникает полный отрицательный заряд. Для восстановления ароматичности протон водорода отщепляется от атома углерода кольца и переходит к отрицательно заряженному кислороду. Образуется бензолсульфокислота.
Когда мы рассматриваем реакции электрофильного замещения в бензоле, перед нами не стоит вопрос, в каком положении протекает реакция, т.к. все атомы углерода абсолютно равноценны. Другое дело, если в бензольном кольце уже есть заместитель. В этом случае в результате электрофильного замещения принципиально возможно образование трёх изомеров:
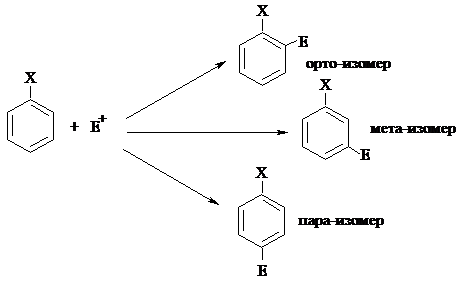 |
Чтобы ответить на вопрос, какой из этих возможных продуктов является преобладающим, необходимо рассматривать электронные эффекты заместителя.
Отвлечёмся от реакций электрофильного замещения в бензоле и его производных и рассмотрим электронные эффекты в целом.
Взаимное влияние атомов в молекулах органических
соединений. Электронные эффекты
Атомы и атомные группы в молекулах органических соединений влияют друг на друга, причём не только атомы, непосредственно связанные друг с другом. Это влияние каким-то образом передаётся по молекуле. Передача влияния атомов в молекулах за счёт поляризации связей называетсяэлектронными эффектами. Существует два вида электронных эффектов: индуктивный и мезомерный эффект.
Индуктивный эффект - это передача влияния заместителей по цепи σ-связей за счёт их поляризации. Индуктивный эффект обозначается символом I. Рассмотрим его на примере 1-хлорбутана:
Связь C-Cl полярна из-за более высокой электроотрицательности хлора. На атоме углерода возникает частичный положительный заряд (δ+). Электронная пара следующей σ-связи смещается в сторону электронодефицитного атома углерода, т.е. поляризуется. За счёт этого на следующем атоме углерода также возникает частичный положительный заряд (δ+’) и т.д. Таким образом, хлор индуцируетполяризацию не только «собственной» σ-связи, но и последующих в цепи. Обратите внимание, что каждый последующий частичный положительный заряд по величине меньше предыдущего (δ+>δ+’>δ+’’>δ+’’’), т.е. индуктивный эффект передаётся по цепи с затуханием. Это можно объяснить низкой поляризуемостью σ-связей. Принято считать, что индуктивный эффект распространяется на 3-4 σ-связи. В приведенном примере атом хлора смещает электронную плотность по цепи связей на себя. Такой эффект называют отрицательным индуктивным эффектом и обозначают –ICl.
Большинство заместителей проявляют отрицательный индутивный эффект, т.к. в их структуре есть атомы, более электроотрицательные, чем водород (индуктивный эффект водорода принят равным нулю). Например: -F, -Cl, -Br, -I, -OH, -NH2, -NO2,
-COOH, >C=O .
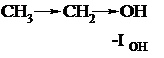 | 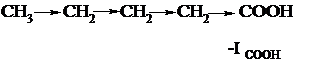 | ||
Если заместитель смещает электронную плотность по цепи σ-связей от себя, он проявляет положительный индуктивный эффект (+I). Например:
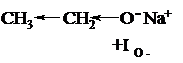
Кислород с полным отрицательным зарядом проявляет положительный индуктивный эффект.

В молекуле пропена углерод метильной группы sp3-гибридизован, а атомы углерода при двойной связи sp2-гибридизованы, т.е. более электроотрицательны. Поэтому метильная группа смещает электронную плотность от себя, проявляя положительный индуктивный эффект (+ICH3) .
Итак, индуктивный эффект может проявляться в любой молекуле, в которой есть разные по электроотрицательности атомы.
Мезомерный эффект – это передача электронного влияния заместителей в сопряжённых системах, посредством поляризации π-связей. Мезомерный эффект передаётся без затухания, т.к. π-связи поляризуются легко. Обратите внимание: мезомерным эффектом обладают только те заместители, которые сами являются частью сопряжённой системы. Например:
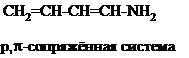  | Амино-группа является частью p,π-сопряжённой системы. |
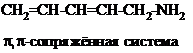  | Амино-группа не является частью сопряжённой системы. Мезомерный эффект отсутствует. |
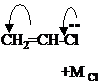 Мезомерный эффект может быть как положительный (+М), так и отрицательный (-М).
Мезомерный эффект может быть как положительный (+М), так и отрицательный (-М).
В молекуле хлорвинила неподелённая электронная пара хлора участвует в p,π-сопряжении, т.е. вклад хлора в сопряжённую систему больше, чем у каждого из атомов углерода. Поэтому хлор проявляет положительный мезомерный эффект.
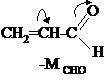 Молекула акрилового альдегида – это
Молекула акрилового альдегида – это
π.π-сопряжённая система. Атом кислорода отдаёт в сопряжение один электрон – столько же, как и каждый атом углерода, но при этом электроотрицательность кислорода выше, чем у углерода, поэтому кислород смещает электронную плотность сопряжённой системы на себя, альдегидная группа в целом проявляет отрицательный мезомерный эффект.
Итак, заместители, отдающие в сопряжение два электрона, обладают положительным мезомерным эффектом. К ним относятся:
а) заместители с полным отрицательным зарядом, например, –O-;
б) заместители, в структуре которых есть атомы с неподелёнными электронными парами на pz-орбитали, например: -NH2, -OH,
-F, -Cl, -Br-, -I, -OR (-OCH3, -OC2H5).
Заместители, смещающие электронную плотность по сопряжённой системе на себя, проявляют отрицательный мезомерный эффект. К ним относятся заместители, в структуре которых есть двойные связи, например:
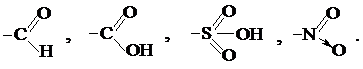 |
Заместитель может проявлять и индуктивный, и мезомерный эффекты одновременно. В некоторых случаях направление этих эффектов совпадает (например, -I и –M), в других – они действуют в противоположных направлениях (например, -I и +M). Как в этих случаях определить общее влияние заместителя на остальную часть молекулы (другими словами, как определить, является данный заместитель электронодонорным или электроноакцепторным)? Заместители, повышающие электронную плотность в остальной части молекулы, называют электронодонорными, а заместители, понижающие электронную плотность в остальной части молекулы, – электроноакцепторными.
Чтобы определить общее влияние заместителя, необходимо сравнить его электронные эффекты по величине. Если преобладает положительный по знаку эффект, заместитель является электронодонорным. Если преобладает отрицательный по знаку эффект, заместитель является электроноакцепторным. Нужно отметить, что, как правило, мезомерный эффект проявляется сильнее, чем индуктивный (из-за большей способности π-связей к поляризации). Однако есть и исключения из этого правила: индуктивный эффект галогенов проявляется сильнее, чем мезомерный.
Рассмотрим конкретные примеры:
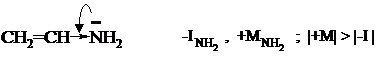 В этом соединении аминогруппа является электронодонорным заместителем, т.к. её положительный мезомерный эффект проявляется сильнее, чем отрицательный индуктивный.
В этом соединении аминогруппа является электронодонорным заместителем, т.к. её положительный мезомерный эффект проявляется сильнее, чем отрицательный индуктивный.
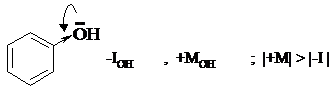
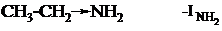 В этом соединении аминогруппа является электроноакцепторным заметителем, т.к. проявляет только отрицательный индуктивный эффект.
В этом соединении аминогруппа является электроноакцепторным заметителем, т.к. проявляет только отрицательный индуктивный эффект.
В молекуле фенола гидроксильная группа является электронодонорным заместителем из-за преобладания положительного мезомерного эффекта над отрицательным индуктивным.
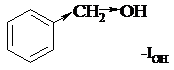 В молекуле бензилового спирта гидроксильная группа не участвует в сопряжении и проявляет только отрицательный индуктивный эффект. Поэтому она является электроноакцепторным заместителем.
В молекуле бензилового спирта гидроксильная группа не участвует в сопряжении и проявляет только отрицательный индуктивный эффект. Поэтому она является электроноакцепторным заместителем.
Эти примеры показывают, что нельзя рассматривать влияние какого-либо заместителя вообще, а нужно рассматривать его влияние в конкретной молекуле.
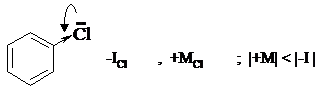 Только галогены всегда являются электроноакцепторными заместителями, т.к. их отрицательный индуктивный эффект проявляется сильнее, чем положительный мезомерный. Например:
Только галогены всегда являются электроноакцепторными заместителями, т.к. их отрицательный индуктивный эффект проявляется сильнее, чем положительный мезомерный. Например:
А теперь вернёмся к реакциям электрофильного замещения в производных бензола. Итак, мы выяснили, что заместитель, уже имеющийся в кольце, влияет на ход реакций электрофильного замещения. В чём же выражается это влияние?
Заместитель влияет на скорость реакций SE и на положение второго заместителя, вводимого в кольцо. Рассмотрим оба этих аспекта влияния.
Влияние на скорость реакции. Чем выше электронная плотность в кольце, тем легче протекают реакции электрофильного замещения. Понятно, что электронодонорные заместители облегчают реакции SE (являются активаторами цикла), а электроноакцепторные заместители – затрудняют их (дезактивируют цикл). Поэтому реакции электрофильного замещения в производных бензола, содержащих электроноакцепторные заместители, проводят в более жёстких условиях.
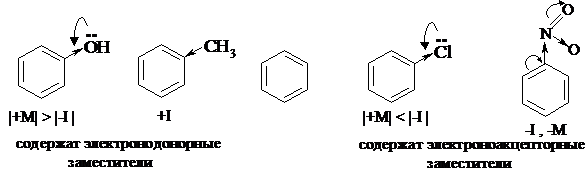 Сравним активность фенола, толуола, бензола, хлорбензола и нитробензола в реакции нитрования.
Сравним активность фенола, толуола, бензола, хлорбензола и нитробензола в реакции нитрования.
Так как фенол и толуол содержат электронодонорные заместители, они более активны в реакциях SE, чем бензол. Наоборот, хлорбензол и нитробензол менее активны в этих реакциях, чем бензол, т.к. содержат электроноакцепторные заместители. Фенол активнее толуола из-за положительного мезомерного эффекта OH-группы. Хлор не такой сильный электроноакцепторный заместитель, как нитрогруппа, т.к. нитрогруппа проявляет и отрицательный индуктивный, и отрицательный мезомерный эффекты. Итак, в данном ряду активность в реакциях электрофильного замещения убывает от фенола к нитробензолу. Экспериментально установлено, что если скорость реакции нитрования бензола принять за 1, то этот ряд будет выглядеть так:
| фенол | толуол | бензол | хлорбензол | нитробензол | |
| скорость нитрования | 24,5 | 1,0 | 0,033 | 0,0000001 |
Вторым аспектом влияния заместителя в ароматическом кольце на ход реакций электрофильного замещения является так называемое ориентирующее действие заместителей. Все заместители можно подразделить на две группы: орто-, пара-ориентанты (заместители 1 рода) и мета-ориентанты (заместители 2 рода).
К заместителям 1 рода относятся: -OH, -O-, -NH2, алкильные группы (-CH3, -C2H5 и т.д.) и галогены. Вы можете видеть, что все эти заместители проявляют положительный индуктивный эффект и (или) положительный мезомерный эффект. Все они, кроме галогенов, повышают электронную плотность в кольце, особенно в орто- и пара-положениях. Поэтому электрофил и направляется в эти положения. Рассмотрим это на примере фенола:
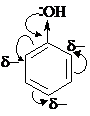 За счёт положительного мезомерного эффекта гидроксильной группы происходит перераспределение электронной плотности по сопряжённой системе, и в орто- и пара-положениях она особенно повышена.
За счёт положительного мезомерного эффекта гидроксильной группы происходит перераспределение электронной плотности по сопряжённой системе, и в орто- и пара-положениях она особенно повышена.
 При бромировании фенола образуется смесь орто- и пара-бромфенола:
При бромировании фенола образуется смесь орто- и пара-бромфенола:
Если бромирование проводить в полярном растворителе (бромной водой) и использовать избыток брома, реакция протекает сразу по трём положениям:
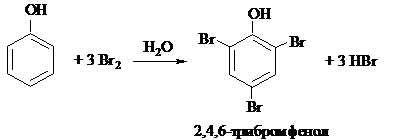 |
Заместителями 2 рода являются: -NH3+, -COOH, -CHO (альдегидная группа), -NO2, -SO3H. Все эти заместители понижают электронную плотность в ароматическом кольце, но из-за её перераспределения в мета-положениях она понижена не так сильно, как в орто- и пара-. Рассмотрим это на примере бензойной кислоты:
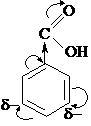 Карбоксильная группа проявляет отрицательный индуктивный и отрицательный мезомерный эффекты. За счёт перераспределения по сопряжённой системе в мета-положениях электронная плотность остаётся более высокой, чем в орто- и пара-, поэтому электрофил будет атаковать мета-положения:
Карбоксильная группа проявляет отрицательный индуктивный и отрицательный мезомерный эффекты. За счёт перераспределения по сопряжённой системе в мета-положениях электронная плотность остаётся более высокой, чем в орто- и пара-, поэтому электрофил будет атаковать мета-положения:
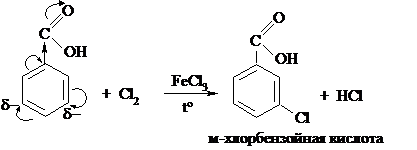 |
