Виды коррозии: химическая и электрохимическая коррозия. Общее представление о защите металлов от коррозии.
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентировании полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Механизм образования ДЭС
Двойной электрический слой возникает при контакте двух фаз, из которых хотя бы одна является жидкой. Стремление системы понизить поверхностную энергию приводит к тому, что частицы на поверхности раздела фаз ориентируются особым образом. Вследствие этого контактирующие фазы приобретают заряды противоположного знака, но равной величины, что приводит к образованию двойного электрического слоя. Можно выделить три механизма образования ДЭС:
1. Переход ионов или электронов из одной фазы в другую (поверхностная ионизация). Примером может служить диссоциация поверхностных функциональных групп, принадлежащих одной из фаз (как правило, твердой). Для определения знака заряда поверхности используется правило Фаянса — Панета
2. Преимущественная адсорбция в межфазном слое ионов одного знака.
3. Ориентирование полярных молекул в поверхностном слое. По этому механизму ДЭС образуется в случае, если вещества, составляющие фазы системы не могут обмениваться зарядами. Для определения знака заряда поверхности используют правило Кёна, гласящее, что из двух соприкасающихся фаз положительно заряжается та, которая имеет большую диэлектрическую проницаемость.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) встандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различияэлектростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
Fe3+ + 3e− → Fe(тв) −0.036 В
Fe2+ + 2e− → Fe(тв) −0.44 В
Для получения третьего уравнения:
Fe3+ + e− → Fe2+ (+0.77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов вэлектролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани.
Электроды сравнения — электрохимические системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения величины потенциала отдельного электрода. Применяется, в частности, в составе электролитических ячеек.
В качестве электрода сравнения может служить любой электрод в термодинамически равновесном состоянии, удовлетворяющий требованиям воспроизводимости, постоянства во времени всех характеристик и относительной простоты изготовления. Для водных электролитов наиболее часто применяют в качестве электродов сравнения водородный, каломельный, галогеносеребряные,оксидно-ртутный и хингидронный электроды.
^ Ряд стандартных электродных потенциалов металлов (ряд напряжений).Располагая металлы в порядке возрастания алгебраической величины их стандартных электродных потенциалов (Е0) получают ряд стандартных электродных потенциалов металлов в водных растворах или ряд напряжений металлов. Ряд напряжений характеризует:
1.Чем меньше алгебраическая величина потенциала, тем выше восстановительная способность металла и тем ниже окислительная способность его ионов.
2.Каждый предыдущий металл, т. е. расположенный в ряду напряжения левее или имеющий меньший стандартный потенциал, вытесняет последующие металлы из водных растворов их солей. Например:
Mg + NiSO4=MgSO4 + Ni ;
3.Все активные металлы, т.е. расположенные в ряду до водорода, вытесняют водород из кислот, где он выполняет функцию окислителя (HCl разб. и конц.; H2SO4 разб.).
2HCl + Zn = ZnCl2 + H2
4.Большой энергией гидратации иона Li(-515 кДж/г-ат) обусловливается высокоотрицательное значение его потенциала (Е0 = -3,045 B) в сравнении с Na, K и даже Cs (E0 = - 2,923 B). Это относится и к кальцию, который активнее в растворе, чем натрий.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
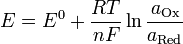 ,
,
Где 1.  — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
2. 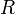 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
3. 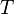 — абсолютная температура;
— абсолютная температура;
4.  — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
5.  — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
6. 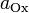 и
и 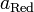 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 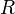 и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при 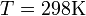 получим
получим
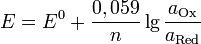
Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер.
Химическая коррозия – это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте (например, окисление магния при нагревании на воздухе).
Электрохимическая коррозия – это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
