Докажите амфотерные свойства оксида хрома(III) и гидроксида цинка, приведите уравнения соответствующих реакций.
Гидроксид цинка — амфотерныйгидроксид, имеющий формулу Zn(OH)2.
Чтобы доказать амфотерность гидроксида рассмотритепример. Для этого используйте гидроксид цинка Zn(OH)2.
В обе колбы со шлифом налейте равное небольшое количество раствора хлористого цинка. Вставьте в первую колбу капельную воронку с раствором гидроксида натрия, осторожно отверните кран и медленно начните приливать щелочь к цинковой соли. Почти сразу образуется рыхлый белый осадок. Это показатель, что протекает следующая реакция: ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Далее продолжайте приливать раствор гидроксида натрия к осадку гидроксида цинка. Через некоторое время вы заметите, что осадок начинает постепенно исчезать, и вскоре в колбе будет лишь прозрачный раствор. Что же произошло? Гидроксид цинка превратился в растворимое комплексное соединение Na2ZnO2. Произошла реакция: Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
То есть гидроксид цинка вступает в реакцию с сильной щелочью. Но вступает ли он в реакцию с кислотой? В другую колбу точно так же начните доливать раствор гидроксида натрия. Как только образуется рыхлый белый осадок, смените капельную воронку и начните вливать уже соляную кислоту, только делайте все медленно. Вы заметите, что осадок очень быстро исчезнет. Почему так случилось? Гидроксид цинка вступил в реакцию с соляной кислотой, образовав растворимую соль, произошла следующая реакция: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Поскольку гидроксид цинка реагирует и со щелочью, и с кислотой, он амфотерен. Таким образом, вы доказали, что требовалось
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ №25
Виды и особенности химической связи.

Степень окисления . Окислитель. Восстановитель. Процесс окисления. Процесс восстановления.
Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Окислитель – принимает электроны (восстанавливается)
Восстановитель – отдает электроны (окисляется)
Окисление – процесс отдачи электронов.
Восстановление – процесс принятия электронов.
Составьте формулы
сульфата алюминия - Al2(SO4)3.
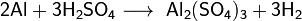
Дигидрофосфата кальция - Ca(H2PO4)2
Гидроксокарбоната меди(II).
(CuOH)2CO3
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 26
Ковалентная связь. Метод валентных связей.
Ковалентная связь – возникает между атомами в результате образования общих электронных пар.
Основные положения метода валентных связей:
1) В образовании химической связи участвуют только неспаренные электроны внешней электронной оболочки.
2) Химическая связь образуется между двумя электронами, имеющими противоположно направленные спины
3) При образовании химической связи происходит перекрывание электронных облаков. В области перекрывания создается зона повышенной электронной плотности. Она способствует притяжению атомов друг к другу.
4) Химическая связь осуществляется в том направлении, где обеспечивается наибольшее перекрывание электронных облаков.
Метод электронного баланса.
Метод электронного баланса — один из методов уравнивания окислительно-восстановительных реакций (ОВР).Заключается в том чтобы на основании степеней окисления расставить коэффициенты в ОВР. Для правильного уравнивания следует придерживаться определённой последовательности действий:
1) Найти окислитель и восстановитель.
2) Составить для них схемы (полуреакции) переходов электронов, отвечающие данному окислительно-восстановительному процессу.
3) Уравнять число отданных и принятых электронов в полуреакциях.
4) Просуммировать порознь левые и правые части полуреакций.
5)Расставить коэффициенты в уравнении окислительно восстановительной реакции.
