ЭДС гальванического элемента. Электрохимический критерий осуществления окислительно-восстановительных реакций
Каждый гальванический элемент состоит из двух электродов (окислительно-восстановительных пар), один из которых является поставщиком электронов (анод), а другой их принимает (катод). В гальванических элементах источником электрического тока является химическая реакция. Любая химическая реакция термодинамически разрешена, если DG < 0. Из соотношений DG= –nFEиDG0= –nFE0,следует, что электрохимическая реакция, а в общем случае любая окислительно-восстановительная реакция может протекать самопроизвольно, если E > 0или для стандартных условий E0 > 0.
В соответствии с принятой формой записи гальванического элемента его ЭДС будет > 0, если из электродного потенциала катода (электрода окислителя) вычесть электродный потенциал анода (электрода восстановителя).
Eэлемента = Eкатода – Eанода > 0
Eреакции = Eох – Ered > 0 .
Пользуясь этими соотношениями и таблицей стандартных электродных потенциалов, можно предсказать возможность осуществления, а в случае гальванического элемента направление окислительно-восстановительных реакций в реальных нестандартных условиях.
Так, для элемента Даниэля - Якоби
(–) Zn |Zn2+ || Cu2+|Cu (+)
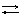 Zn + Сu2+ Zn2+ + Cu
Zn + Сu2+ Zn2+ + Cu
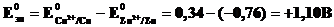 .
.
В стандартных условиях реакция идёт в прямом направлении.
Для нестандартных условий ЭДС элемента (реакции) находится из разности электродных потенциалов катода и анода, вычисленных по уравнению Нернста:

Выполнив необходимые преобразования и поменяв знак (-) на (+) перед логарифмическим слагаемым, получим уравнение Нернста для реакции,протекающей в ГЭ Даниэля - Якоби
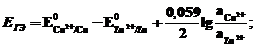

В гальваническом элементе, описываемом схемой
(-) Pt│Fe3+, Fe2+ │H+│ MnO4- , Mn2+│ Pt (+)

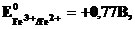
протекают полуреакции:
(-) (5Fe2+ - 5ē = 5Fe3+) (+) (MnO4-+8H+ +5ē = Mn2+ + 4H2O).
Суммарная реакция:
 MnO4– + 5 Fe2+ + 8 H+ Mn2+ + 5Fe3+ + 4H2O
MnO4– + 5 Fe2+ + 8 H+ Mn2+ + 5Fe3+ + 4H2O
и уравнение Нернста для этого элемента имеет вид:

Обратите внимание, что величины электродных потенциалов и ЭДС реакции в целом определяются концентрациями (активностями) всех ионов, участвующих в окислительно-восстановительном процессе (Н+, Н2О), а в уравнении Нернста для реакциипод знаком логарифма в числителе стоят концентрации исходных веществ, а в знаменателе – продуктов реакции в степенях стехиометрических коэффициентов.
В большинстве случаев о возможности и направлении окислительно-восстановительных реакций можно судить по разности стандартных электродных потенциалов E0ок – E0вос.. В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активностей ионов) электродных потенциалов, вычисленных по уравнению Нернста.
Равновесное состояние любой окислительно-восстано-вительной реакции характеризуется нулевой ЭДС. Тогда из соотношенийDG0= –nFE0 и ∆G0 = -RT ln Kрав. cледует
lg K рав. = 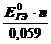 , или
, или 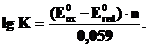
Таким образом, предоставляется возможность определить константу равновесия из электрохимических данных.
