Цианиды – неорганические соединения, содержащие группу CN, соли цианисто-водородной (синильной) кислоты.
20. Кремний, строение атома. Важнейшие соединения, их свойства, применение.
Кремний – второй после кислорода по расположенности в земной коре элемент.
Число протонов и электронов: 12.
Степени окисления (выделена наиболее характерная): -4,+2,+4.
Валентность (жирным выделена наиболее характерная): II, IV.
Кремний дает два типа оксидов – оксид кремния (IV) и оксид кремния (II). Оксид кремния (IV) наиболее прочный, не разлагается при высоких температурах и выше 223°С переходит в парообразное состояние. Не восстанавливает его и водород. Более того: сам кремний иногда применяется в качестве восстановителя, например при получении молибдена:
2MoO3+3Si 3SiO2+2Mo
Поскольку при окислении кремния выделяется громадное количество теплоты, оксид кремния (IV) и молибден получаются в расплавленном состоянии.
При нормальных условиях кремний химически малоактивен и активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствии кислорода, воздуха или воды (водяных паров).
Технический кремний находит следующие применения:
1. сырьё для металлургических производств: компонент сплава (бронзы, силумин); раскислитель (при выплавке чугуна); модификатор свойств металлов или легирующий элемент (например, добавка определённого количества кремния при производстве трансформаторных сталей увеличивает коэрцитивную силу готового продукта) и т. п.;
2. сырьё для производства более чистого поликристаллического кремния и очищенного металлургического кремния;
3. сырьё для производства кремнийорганических материалов, силанов;
4. иногда кремний технической чистоты и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях;
5. для производства солнечных батарей.
21. Общая характеристика элементов III группы главной подгруппы. Применение.
Элементы главной подгруппы III группы периодической системы – бор, алюминий, галлий, индий и таллий. На внешнем электронном слое они содержат три электрона. Бор, алюминий, галлий и индий в своих соединениях имеют степенно окисления +3. С увеличением порядкового номера металлические свойства элементов подгруппы усиливаются. Бор имеет ярко выраженные неметаллический характер.
Из элементов III группы только бор и алюминий используются в ветеринарной медицине. Некоторые их соединения находят применение в фармацевтической практике как лекарственные препараты.
Соединения бора с металлами (бориды) обладают высокой твердостью и термостойкостью. Поэтому их используют для получения сверхтвердых и жаропрочных специальных сплавов. Большой термостойкостью обладают карбид и нитрид бора. Последний применяют в качестве высокотемпературной смазки.
22. Бор. Строение атома, валентность. Важнейшие соединения. Применение.
Бор является микроэлементом, играющим определенную физиологическую роль в организме. В виде борной кислоты H3BO3 содержится в незначительных количествах в ягодах, фруктах, хмеле, а иногда и в вине. В ветеринарной практике соединения бора применяются в виде борной кислоты Н3ВО3 Na2B4O7, которые обладают дезинфицирующим свойством.
Химический элемент III группы периодической системы, атомный номер 5.
Степени окисления +3 (валентность III).
Конфигурация электронной оболочки: 1s22s2p1.
23.Алюминий и его соединения. Применение.
Алюми́ний - элемент главной подгруппы третьей группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Алюминий - легкоплавкий серебристый металл малой плотности, обладает высокой электрической проводимостью и пластичностью. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования оксидной плёнки, защищающей поверхность от дальнейшего взаимодействия. Al - химически активный металл (МЕ). После удаления защитной плёнки Al окисляется до Al2O3 и реагирует с водой вытесняя из неё водород:
4Al + 3O2 = 2Al2O3, 2Al +6H20 +2Al(OH)3 +3H2↑
Al - амфотерный МЕ. Он реагирует и с растворами кислот и с растворами щелочей: 2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2↑ Алюминий легко растворяется в кислотах, которые разрушают пленку, например в HCl. Но кислоты-окислители (напр. H2SO4, HNO3) наоборот стабилизирует оксидную пленку и Al в них не растворяется.
1) При взаимодействии с водородом получается гидрид алюминия(твердое, нелетучее полимерное соединение), но реакцию проводят косвенным путём: 3LiH + AlCl3 = AlH3 + 3LiCl.
2) При взаимодействии Al с галогенами получаются галогениды алюминия, среди них отличается по свойствам - фторид алюминия AlF3(термодинамически устойчивое соед. с высокой температурой плавления, малорастворим в воде)
3) с O2 Al образует Al2O3(cуществует в нескольких кристаллических модификациях и аморфном состоянии)
4)образование гидроксида Al(существует в нескольких кристалльческих состояниях):
a) аморфный гидроксид в виде студенистого белого осадка AlCl3 + 3NH4OH = Al(OH)3↓ + 3NH4Cl
b) гиббсит(гидрагиллит) образуется при медленном пропускании газообразного оксида углерода (IV) в раствор гидроксоалюминатов щелочных МЕ, т.е. при очень осторожном снижении рН этих растворов: Na[Al(OH)4(OH2)2] + H2O + CO2 → [Al(OH)3(OH2)3] + NaHCO3
5)образование комплексных соединений: LiH + AlH3 = Li[AlH4] тетрагидроалюминат(III) лития или аланат; 3NaF +AlF3 = Na3[AlF6] гексафтораюминат натрия
Применение: Al находит самое широкое применение. Он используется: в электротехнике, в самолето- и машиностроении, в производстве теплообменных аппаратов, в радиотехнике. Алюминием покрывают изделия, создавая тем самым защиту от коррозии, гидроксид Al применяют для очистки воды.
24. Общая характеристика элементов главной подгруппы II группы. Применение.
Ко II группе период. системы элементов относятся бериллий, щелочноземельные Ме: магний, кальций, стронций, барий, радий. Щелочноземельными эти МЕ являются, потому что их оксиды (земли)дают с водой щелочные растворы. Для этих элементов характерна сравнительно низкая температура плавления и высокая летучесть. Растворимость гидроксидов щелочнозем. МЕ увеличивается от Mg к Ba: гидроксид магния почти не растворяется в воде, гидрокс. кальция растворяется слбо, гидроксид бария - хорошо. Растворимость же многих солей уменьшается от магния к радию: сульфат магния хорошо растворяется в воде, сульфат кальция - плохо, сульфаты стронция, бария, радия - почти нерастворимы.
Металлический Be применяется для изготовления окон к рентгеновским установкам, т.к. он поглощает рентгеновские лучи в 17 раз слабее алюминия. Добавка бериллия к сплавам увеличивает их твердость и электропроводность. Нитрат стронция применяется в пиротехнике, его карбонат и оксид используют в сахарной промышленности. Хлорид бария используют в лабораторной практике, сульфат бария - в рентгеноскопии органов пищеварения. Соединения радия применяют для получения радона, обладающего целебными свойствами. Соли радия применяют в исследовательских целях. Благодаря способности кадмия образовывать защитную оксидную пленку он является устойчивым антикоррозионным покрытием. Магний применяют для получения различных легких сплавов; его добавляют для улучшения механических свойств; магний - восстановитель редких МЕ. Кальций применяется в металлургии; он восстанавливает оксиды и хлориды в производстве многих редких МЕ; в промышленности оксид кальция применяют как выжущий материал.
25. Жесткость воды и способы её устранения.
Различают временную (устранимую) и постоянную жесткость воды. Временную жесткость, вызванную наличием кидрокарбонатов кальция и магния, можно устранить кипячением:
Ca(HCO3)2 = CaCO3↓ +CO2↑ + H2O
при этом образуется осадок - труднорастворимая соль карбонат кальция (магния), и содержание кальция(магния) в воде снижается, т.е. жесткость воды уменьшается. Временную жесткость называют также карбонатной жесткостью.
Наличие в воде сульфатов и хлоридо кальция и магния обусловливает постоянную жетскость воды. Эти соли не выделяются в осадок кипячением, для их устранения необходимо проводить специальную очистку воды. Различают кальциевую жесткость воды - обусловлена наличием кальциевых солей, и магниевую - из-за магниевых солей. Суммарная кальциевая и магниевая жескость называется общей жесткостью. Жесткость воды выражают в мг-экв/л и находят по формуле: Общ.ж. = [Ca2+]/20,04 + [Mg2+]/12,16 , где [Ca2+] и [Mg2+] - содержание кальция и магния в 1л воды. Для умягчения воды применяют два метода: осаждение и ионный обмен. Для осаждения Mg и Ca аиболее широко применяют соду, известь, фосфат Na и др. Известь взаимодействует с солями Mg и осаждает Mg в виде гидроксида: MgCl2 +Ca(OH)2 = Mg(OH)2↓ + CaCl2.
Сода взаимод. с солями кальция, образуя труднорастворимый карбонат кальция: CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4
Для устранения временной жесткости методом осаждения используют:
а)известковый метод Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ +H2O, Mg(HCO3)2 + 2Ca(OH)2 = 2CaCO3↓ + Mg(OH)2↓ + 2H2O
b) Натронный метод Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2O, Mg(HCO3)2+4NaOH=Mg(OH)2↓+2Na2CO3+2H2O
c)Содовый метод: Ca(HCO3)2 + Na2CO3 = CaCO3↓ + 2NaHCO3, Mg(HCO3)2 +Na2CO3 = MgCO3↓ + 2NaHCO3.
Для устранения постоянной жесткости используют содовый и фосфатный медоды: CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4,
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4.
3CaSO4 +2Na3PO4 - Ca3PO4 = Ca3(PO4)2↓ + 3Na2SO4, 3MgSO4 + 2Na3PO4 = Mg3(PO4)2↓ +3Na2SO4.
Ионный обмен - ионообменные смолы Ионный обмен и ионообменные смолы применяются с 60 годов. Но промышленная деминерализация и умягчение воды стали применятся только с развитием производства и расширением ассортимента ионообменных смол. Ионообменные смолы сорбенты – иониты – твердые, нерастворимые, вещества в виде мелкодисперсных шариков. В основе этих смол – лежит синтетическая матрица (каркас), содержащая положительный или отрицательный заряд, и противоин компенсирующий заряд матрицы.
Очистка воды происходит в результате обмена элементов (положительно или отрицательно зараженных) матрицы ионообменной смолы на элементы растворенных в воде загрязнений. Таким образом, концентрация растворенных загрязнений существенно падает. В последствии, во время регенерации систем водоподготовки накопленные загрязнения из воды сбрасываются в дренаж.
26.Щелочные МЕ. Изменение потенциала ионизации. Роль в окислительно-восстановительных процессах. Важнейшие соединения, биологическая роль, применение.
Щелочные МЕ: литий, натрий, калий, рубидий, цезий, франций. Данные МЕ назвали щелочными, т.к. при взаимодействии с водой они образуют растворимые в воде основания – щелочи. Щелочные МЕ – это элементы главной подгруппы первой группы периодической системы.
Они легко отдают электроны, поэтому являются очень сильными восстановителями. Во всех соединениях проявляют степень окисления +1. От лития к цезию восстановительные свойства усиливаются, активный металл цезий. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
Для МЕ характерна мягкость, труднее всего резать литий, тогда как натрий и калий легко поддаются скальпелю. В природе щелочные металлы находятся в виде соединений, потому что обладают высокой химической активностью, которая в свою очередь, зависит от особенностей электронного строения атомов (наличие одного неспаренного электрона на внешнем энергетическом уровне)
Щелочные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами ( с галогенами, водородом, образуя гидриды). Из сложных веществ с водой – образуя растворимые в воде основания – щелочи и с кислотами. 2Na + O2 = Na2O2, 2Na + H2 = 2NaH, KCI + NaNO3 = KNO3 + NaCI и т.д.
Щелочные металлы и их соединения широко используются в технике. Литий применяется в ядерной энергетике. Цезий и рубидий применяются для изготовления фотоэлементов. Гидроксид натрия - один из важнейших продуктов основной химической промышленности. NaOH применяется при производстве искусственного волокна в мыловаренной промышленности, бумажной, текстильной и др. Пероксид натрия (NaHO2) применяется для отбелки тканей, шерсти, шëлка и т. п. Поваренная соль NaCl. Главные потребители гидроксида калия(КОН) - мыловарение. КСI - наиболее концентрированное калийное удобрение. Нитрат калия (калийная селитра) КNO3, метафосфат калия КРО3, сульфат калия К2SO4, карбонат калия (или поташ) К2СО3 - это всё удобрения.
27. Хром. Строение атома. Возможные степени окисления. Кислотно-основные свойства. Применение.
Сг - элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов. В свободном виде — голубовато-белый металл, отличающийся большой твердостью и хрупкостью. Конфигурация внеш. электронных оболочек атома 3d54s1; степени окисления +2, +3, +6, реже +4, +5, +1. При нагревании Cr взаимодействует с O2, галогенами, N2, C, S и др. 4Cr + 3O2 = 2Cr2O3 (оксид хрома), 2Cr + 3Cl2=2CrCl3 (хлорид хрома),
В зависимости от валентности хром может проявлять как кислотные, так и основные свойства. На примере оксидов хрома: СrО3 имеет кислотный характер:
CrO3 + H2O = H2CrO4, CrO3 + СаО = СаCrO4,
Cr2O3 -амфотерный(реагирует и с кислотами и с основаниями): Cr2O3 + 6HCl → 2CrCl3 + 3H2O, Cr2O3 + 2KOH → 2KCrO2 + H2O,
CrO - основный. сильный восстановитель:
CrO + 2HCl = CrCl2 + H2O
Применение: хромом покрывают железные и стальные детали и инструменты, которые используются в промышленности. Наибольшее кол-во хрома применяется в металлургии для получения хромистых сталей. Сплав хрома с никелем и железом обладает большим электрическим сопротивлением и применяется для изготовления спиралей электронагревательных приборов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
28. Окислительно-восстановительные свойства соединений хрома с различной степенью окисления.
Реакции в кислотной среде.
В кислотной среде соединения Сr+6 переходят в соединения Сr+3 под действием восстановителей: H2S, SO2, FeSO4
К2Сr2О7 +3Н2S +4Н2SО4 = 3S + Сr2(SО4)3 + K2SO4+ 7Н2О
S-2 – 2e → S0
2Cr+6 + 6e → 2Cr+3
В щелочной среде соединения хрома Сr+3 переходят в соединения Сr+6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, H2O2, KMnO4:
2KCrO2 +3 Br2 +8NaOH =2Na2CrO4 + 2KBr +4NaBr + 4H2O
Cr+3 - 3e → Cr+6
Br20 +2e → 2Br-
29. Амфотерность гидроксида хрома(III). Хромиты, их восстановительные свойства.
Оксид хрома (3) - Сr2О3 – порошок темно–зеленого цвета, нерастворим в воде, тугоплавкий, по твёрдости близок к корунду (ему соответствует гидроксид хрома (3) – Сr(ОН)3). Оксид хрома (3) имеет амфотерный характер, однако в кислотах и щелочах растворяется плохо. Реакции со щелочами идут при сплавлении:
Сr2О3 + 2КОН = 2КСrО2(хромит К) + Н2О
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
Сr2О3 + 6 КОН + 3Н2О = 2К3[Сr(ОН)6]
Сr2О3 + 6НСl = 2СrСl3 + 3Н2О
.Соли хрома. Различают два вида солей: хромиты и хроматы.
Хромитами с общей формулой RCrO2 называются соли хромистой кислоты HCrO2.Сплавляя Cr2O3 со щелочами получают хромиты:
Cr(OH)3 + NaOH = NaCrO2 + 2H2O
Хромиты обладают различной окраской - от темно коричневой до совершенно черной и обычно встречаются в виде сплошных массивов. Хромит мягче многих других минералов, температура плавления хромита зависит от его состава. Хромит имеет металлический блеск и почти нерастворим в кислотах.
30. Хромовая и дихромовая кислоты, их соли, роль в окислительно-восстановительных реакциях.
Хром
Степени окисления 6, 3, 2, 0
Степени окисления +2 соответствует основный оксид CrO. Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гижроксид Cr(OH)3. Степени окисления +6 соответствует кислотный оксид CrO3. Кроме того, существует оксид хрома (IV) CrO2, которому не соответствуют ни кислоты, ни основания.
Сплавляя Cr2O3 со щелочами получают хромиты:
Cr2O3 + 2NaOH → 2NaCrO2 + H2O.
Непрокаленный оксид хрома(III) легко растворяется в щелочных растворах и в кислотах:
Cr2O3 + 6HCl → 2CrCl3 + 3Н2О.
При взаимодействии концентрированной серной кислоты с растворами дихроматов образуются красные или фиолетово-красные кристаллы оксида хрома(VI) CrO3. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + Н2О.
Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O.
31. Марганец. Строение атома. Возможные степени окисления. Кислотно-основные свойства.
Степени окисления 7, 6, 5, 4, 3, 2, 0, −1
Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 25. (25 электронов, 25 протонов)
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители.
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
32. Окислительно-восстановительные свойства соединений марганца в зависимости от степени окисления.
| Окисленная форма | Восстановленная форма | Среда |
| Mn2+ | Mn | H+ |
| Mn3+ | Mn2+ | H+ |
| MnO2 | Mn3+ | H+ |
| MnO2 | Mn2+ | H+ |
| MnO2 | Mn(OH)2 | OH− |
| MnO42− | MnO2 | H+ |
| MnO42− | MnO2 | OH− |
| MnO4− | MnO42− | OH− |
| MnO4− | H2MnO4 | H+ |
| MnO4− | MnO2 | H+ |
| MnO4− | MnO2 | OH− |
| MnO4− | Mn2+ | H+ |
| H-КАКАЯ среда?????????????????????? | OH-какая среда??? |
33. Поведение перманганата калия в различных средах (примеры). Применение.
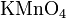
· в кислой среде: 2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O;
· в нейтральной среде: 2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH;
· в щелочной среде: 2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O;
o в щелочной среде на холоде: KMnO4 + K2SO3 + KOH → K2SO4 + K3MnO4 + H2O.
Медицинское применение
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при некоторых отравлениях используют разбавленный раствор.
34. Общая характеристика триады железа. Роль в живом организме.
| Свойства | 26Fe | 27Co | 28Ni |
| Электронная конфигурация* |  | 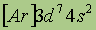 | 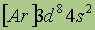 |
| Возможные степени окисления | +2, +3, +6 | +2, +3 | +2, +3, +4 |
| агрегатное состояние (н. у.) | Т В Е Р Д Ы Е В Е Щ Е С Т В А |
Общая характеристика. Элементы железо, кобальт и никель образуют триаду железа, или семейство железо. Атомы элементов триады железа имеют на внешнем энергетическом уровне по 2 электрона, которые они отдают в химических реакциях.
Кобальт и никель менее реакционноспособны, чем железо.
Препараты железа принимают при анемии, малокровии, а так же как кровоостанавливающее средство; в зависимости от концентрации оказывают вяжущее и прижигающее действие
В ветеринарной практике используются металлорганические соединения кобальта , в том числе цианокобаламин и коамид.
Никель – его избыток в почве и растениях может быть причиной заболеваний. (болезни глаз у животных, “боанг” у кокосовых пальм (пустые орехи))
35. Железо, строение атома, степени окисления. Изменение свойств соединений с изменением степени окисления железа. Роль в живом организме. Применение.
26Fe
Степени окисления +2, +3, +6
26 протонов, 26 нейтронов
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2.
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини:
3K3[Fe(CN)6] + 3Fe2+ → 3KFeII[FeIII(CN)6]↓ + 6K+.
Для колчиественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9).
Соединения железа (III)
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+ как правило, окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Ион Fe3+ полностью гидролизуется даже в кислой среде. При рН>4 этот ион практчиески полностью осаждается в виде Fe(OH)3:
Fe3+ + 3H2O = Fe(OH)3 + 3H+
При частичном гидролизе иона Fe3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.
Основные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей:
Fe(OH)3 + 3КОН → K3[Fe(OH)6].
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 → 3FeCl2.
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN−. При взаимодействии ионов Fe3+ с анионами SCN− образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]- Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим. Другим качественным реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:
4K4[Fe(CN)6] + 4Fe3+ → 4KFeIII[FeII(CN)6]↓ + 12K+.
Соединения железа (VI)
Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи, например, феррат(VI) калия K2FeO4. Ферраты окрашены в фиолетовый цвет.
Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде:
Fe + 2KOH + 2H2O = K2FeO4 + 3H2 Ферраты — сильнейшие окислители. В кислой среде разлагаются с выделением кислорода::
4FeO42- + 20H+ = 4Fe3+ + 3O2 + 10H2O
Окислительные свойства ферратов используют для обеззараживания воды.
