Обратимые и необратимые реакции
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇌ 2NH3.
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇌ 2NO2
складывается из элементарных реакций
N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4.
Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горениеуглеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причем скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Смещение химического равновесия
Основная статья: Принцип Ле Шателье — Брауна
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
0моль=0моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия!
ринцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.
Анри Ле Шателье (Франция) сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый Карлом Брауном [1].
Влияние температуры
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому.
N2 + 3H2 ⇄ 2NH3 + Q
Прямая реакция — экзотермическая, а обратная реакция — эндотермическая.
Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Влияние давления
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам: При повышении давления равновесие сдвигается в сторону уменьшения газовых молей при понижении давления равновесие сдвигается в сторону увеличения числа газовых молей N2 + 3H2 ↔ 2NH3
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
§ При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
§ При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями,концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Коллоидне растворы
Коллоидные растворы-жидкие коллоидные системы с частицами дисперсной фазы (мицеллами), свободно и независимо друг от друга перемещающимися в процессе броуновского движения. Золи с водной дисперсионной средой называют гидрозолями, с органическими - органозолями. ;
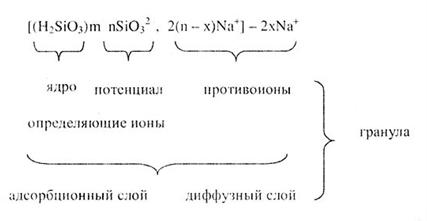
Коллоидные частицы имеют сложное строение. Они состоят из ядер и адсорбированных и притянутых ионов. Рассмотрим строение коллоидной частицы кремниевой кислоты, которая образовалась в результате взаимодействия очень разбавленных растворов силиката натрия и соляной кислоты (Na2Si03 + 2HCl = H2Si03 + 2NaCl). Если Na2Si03находится в избытке, то кремниевая кислота не выпадает в осадок, а образуется прозрачный коллоидный раствор H2Si03. Ядро коллоидной частицы нейтрально, оно состоит из m молекул H2Si03. На поверхности ядра адсорбируются n ионов Si032- , это потенциалопределяющие ионы, так как они обуславливают заряд частицы коллоидного раствора.
Адсорбированные потенциалопределяющие ионы притягивают из раствора ионы противоположного знака — противоионы. В данном случае это ионы Na+, причем часть их 2(n - х) адсорбируется на частице. Адсорбированные ионы Si032- вместе с противоионами Na+ образуют адсорбционный слой. Другая часть противоионов 2xNa+ находится в жидкой фазе и образует подвижный диффузный слой.
Ядро вместе с адсорбционным слоем называется гранулой.
В нашем примере гранула заряжена отрицательно, так как адсорбция ионов Si032- происходит сильнее, чем ионов Na-.
Коллоидная частица вместе с противоионами диффузионного слоя называется мицеллой. Это отдельная частица коллоидного раствора.
Мицелла (коллоидная частица)
Основные свойства
§ Коллоидные частицы не препятствуют прохождению света.
§ В прозрачных коллоидах наблюдается рассеивание светового луча (эффект Тиндаля).
§ Дисперсные частицы не выпадают в осадок за счёт броуновского движения.
Ге́ли (ед.ч. гель, от лат. gelo — «застываю») — дисперсные системы, характеризующиеся структурой, придающей им механические свойства твёрдых тел. Гель — это когерентная система, состоящая из как минимум двух компонентов, как минимум один из которых непрерывно простирается в растворителе. Гели образуются при коагуляции и последующей коалесценции золей. При высушивании гели необратимо разрушаются.
Гели широко используются для производства широчайшего набора продуктов домашнего потребления и бытовой химии, а также для лабораторных исследований методом электрофореза и др. (например, полиакриламидный гель).
Особенно популярен гель для волос, являющийся непременным культурным атрибутом стран Средиземноморья и Латинской Америки, где укладка волос гелем для создания эффекта мокрых волос или контрастного затемнения особенно популярна среди молодых людей.
Золи, коллоидные растворы (нем. sole от лат. solutio — раствор) — это ультрамикрогетерогенные дисперсные системы, размер частиц которых лежит в пределе от 1 до 100 нм (10−9—10−7м).
В зависимости от дисперсионной среды золи бывают твердыми, аэрозолями (газообразная дисперсионная среда) и лиозолями (жидкая дисперсионная среда). В зависимости от природы среды лиозоли называют гидрозолями (вода), органозолями (органическая среда) или, более конкретно, алкозолями (спирты), этерозолями (эфиры) и др. 3оли занимают промежуточное положение между истинными растворами и грубодисперсными системами (суспензиями, эмульсиями). Золи диффундируют медленнее, чем неорганические соли, обладают эффектом светорассеяния (Эффект Тиндаля).
Свойства
§ большая удельная поверхность;
§ адсорбция и плёнкообразование на поверхностях раздела;
§ агрегация, как следствие взаимодействия частиц;
§ частицы на поверхности обладают большей энергией, чем частицы внутри фазы.
