Основным оксидам соответствуют основания, кислотным – кислоты
Основным оксидам соответствуют основания, кислотным – кислоты,
Амфотерным – и те и другие.
НОМЕНКЛАТУРА
ОКСИД + Э(русское название, род. падеж) + (валентность Э)
Примеры:
MgO– оксид магния
NiO – оксид никеля
Сu2О – оксид меди (I)
Fe2O3 – оксид железа (III)
SO2– оксид серы (IV)
SO3 – оксид серы (VI)
Cl2O7 – оксид хлора (VII)
P2O5– оксид фосфора (V)
2.Опишите способы получения оксидов, приведите примеры химических реакций .
Получение оксидов
1. Взаимодействие простых и сложных веществ с кислородом:
CH4 + 2O2 = CO2 + 2H2O
2Mg + O2= 2MgO
4P + 5O2 = 2P2O5
S + O2 = SO2
2CO + O2 = 2CO2
2CuS + 3O2 = 2CuO + 2SO2
4NH3 + 5O2 = 4NO + 6H2O ( в присутствии катализатора)
2. Разложение некоторых кислородсодержащих веществ (оснований,
кислот, солей) при нагревании:
Cu(OH)2 t= Cu2O↓ + H2O
(CuOH)2CO3 = 2CuO + CO2 + H2O
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2HMnO4 = Mn2O7 + H2O ( в присутствии H2SO4(конц.))
3. Опишите химические свойства оксидов
1. Взаимодействие с водой:
-Основные оксиды-- образуется основание:
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
-Кислотные оксиды-- образуется кислота:
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
Исключение SiO2, который с водой не
Реагирует
2. Взаимодействие с кислотой или основанием:
-Основные оксиды-- при реакции с кислотой образуется соль и вода:
MgO + H2SO4 t= MgSO4 + H2O
CuO + 2HCl t= CuCl2 + H2O
-Кислотные оксиды-- при реакции с основанием образуется соль и вода:
CO2 + Ba(OH)2 =BaCO3 + H2O
SO2 + 2NaOH = Na2SO3 + H2O
Амфотерные оксиды взаимодействуют с кислотами как основные:
ZnO + H2SO4 = ZnSO4 + H2O
с основаниями как кислотные:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4])
3. Взаимодействие основных и кислотных оксидов между собой приводит к солям.
Na2O + CO2 = Na2CO3
4. Восстановление до простых веществ:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
P2O5 + 5C = 2P + 5CO
4.Опишите классификацию и номенклатуру основания, приведите примеры
Основания классифицируются по растворимости и по кислотности
- растворимые в воде (щелочи)
М – IА и IIА, кроме Be и Mg
NaOH, Ca(OH)2 ;
- нерастворимые в воде
Ni(OH)2, Cr(OH)3
-oднокислотные: NaOH, KOH - двухкислотные: Ca(OH)2
-трёхкислотные: Fe(OH)3
НОМЕНКЛАТУРА ОСНОВАНИЙ
ГИДРОКСИД + Э(русское название, род. падеж) + (валентность Э)
NaOH – гидроксид натрия
Cr(OH)3 – гидроксид хрома (III)
Ba(OH)2 – гидроксид бария
Опишите способы получения оснований
1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O = Ba(OH)2
3. Электролиз водных растворов солей:
2NaCl + 2H2O = 2NaOH + H2 + Cl2
Опишите химические свойства оснований
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
Щелочи
1. Действие на индикаторы.
лакмус– синий
метилоранж - жёлтый
Нерастворимые основания
----
фенолфталеин - малиновый
2. Взаимодействие с кислотными оксидами.
2KOH + CO2 = K2CO3 + H2O ----
KOH + CO2 = KHCO3
3. Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HNO3 = NaNO3 + H2 Cu(OH)2 + 2HCl = CuCl2 + 2H2O
4. Обменная реакция с солями
Ba(OH)2 + K2SO4 = 2KOH + BaSO4↓ ----
3KOH+Fe(NO3)3 = Fe(OH)3 ↓ + 3KNO3
5. Термический распад.
--- Cu(OH)2 t°= Cu2O + H2O
7.Опишите классификацию и номенклатуру кислот, приведите примеры
НОМЕНКАТУРА КИСЛОТ
1.БЕСКИСЛОРОДНЫЕ КИСЛОТЫ(Н+1 n Э -n )
Э + [o] + водородная кислота
HCl –хлороводородная кислота
HF –фтороводороная кислота
H2S –сероводородная кислота
H2Se –селеноводородная
2.КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ(Н +1 Э +n О -2 )
а) Степень окисления Э = № группы
Э + [ная] кислота
[овая]
б) Степень окисления Э < № группы
Э + [истая] кислота
H2S+6O4 -cерная кислота
H2S+4O3 –сернистая кислота
H3As+5O4 –мышьяковая кислота
H3As+3O3 –мышьяковистая кислота
Опишите способы получения кислот
Получение кислот
1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
SO3 + H2O = H2SO4
P2O5 + 3H2O =2H3PO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 = 2HCl
H2 + S = H2S
3. Реакциями обмена соли с кислотой
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
2NaCl(тв.) + H2SO4(конц.) t°= Na2SO4 + 2HCl
Опишите химические свойства кислот

10.Опишите классификацию и номенклатуру солей, приведите примеры
КЛАССИФИКАЦИЯ
1. Средние (нормальные) – продукт полного замещения атомов водорода в кислоте на металл
а) соли кислородсодержащих кислот
Н2SO4 → Na2SO4 – сульфат натрия
Н2SO3 → Na2SO3 – сульфит натрия
б) соли бескислородных кислот
HCl → KCl - хлорид калия

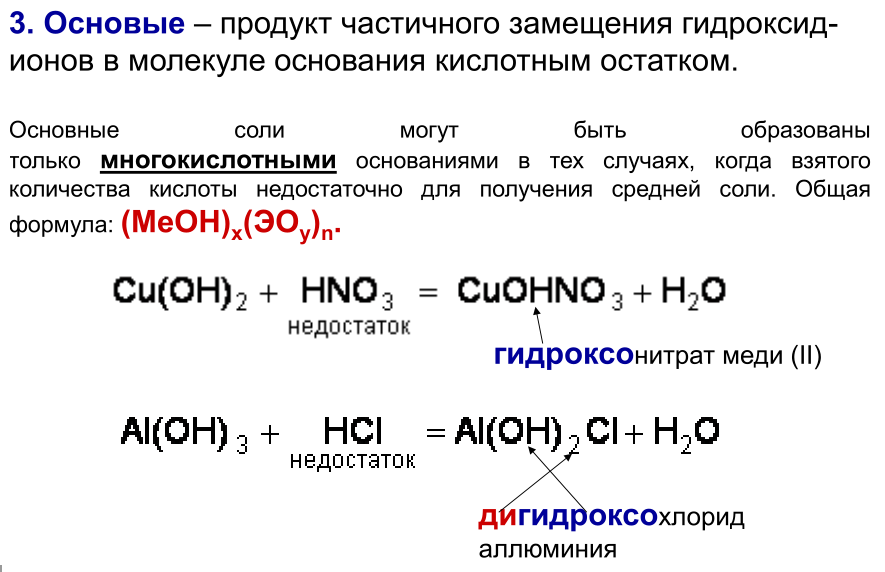
4. Двойные соли состоят из ионов двух разных металлов и кислотного остатка.
KNaCO3 – калий натрий карбонат
5. Смешанные соли – содержат один ион металла и анионы двух кислот.
AlCl(SO4) – алюминий хлорид сульфат.
6. Комплексные соли состоят из сложных (комплексных) ионов
[Ag(NH3)2] Cl
АТОМНЫЙ РАДИУС
· Орбитальный радиус (rорб) – расстояние от ядра до максимума радиальной электронной плотности последнего энергетического уровня ( наибольшие rорб – щелочные и щелочно-земельные металлы, наименьшие rорб – галогены и инертные газы)
· Ковалентный радиус (rk) – половина длины одинарной ковалентной связи между атомами данного элемента ( в том числе для атомов, образующих кратные связи)
· Металлический радиус (rм ) –половина межъядерного расстояния соседних атомов в плотноупакованной кристаллической решетке металла
· Ионный радиус (r+, r-) – считают, что расстояние между ядрами соседних катиона и аниона равно сумме их ионных радиусов
· Ван-дер-ваальсов радиус (rв) – кратчайшее расстояние между атомами, не образующими химической связи
18)Потенциал ионизации атома - минимальная разность потенциалов U, которую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома.
Чаще употребляемое понятие - энергия ионизации E. Это минимальная энергия, которую надо затратить для удаления электрона из атома.
Потенциал ионизации U тесно связан с энергией ионизации соотношением:
E=Ue,
где е-элементарный электрический заряд.
Энергия ионизации атома является внутренним свойством частицы и не зависит от способа ионизации, тогда как потенциал ионизации, можно сказать,- характеристика исторически первого метода ионизации.
Энергия ионизации атома, выраженная в эВ (электроновольтах), численно совпадает с потенциалом ионизации атома, выраженным вВ (вольтах)
Энергии ионизации возрастает в периоде по мере увеличения порядкового номера элемента. Наименьшее ее значение имеют щелочные металлы, находящиеся в начале периода. Наибольшее значение энергии ионизации характерно для инертных газов, находящихся в конце периода.
ПАРАМЕТРЫ ХИМИЧЕСКОЙ СВЯЗИ

ВИДЫ ГИБРИДИЗАЦИИ

Свойства ковалентной связи
1.Энергия связи 2. Длина связи 3. Кратность связи 4. Насыщаемость 5. Направленность 6. Полярность 7. Поляризуемость
Виды ковалентной связи

ИОННАЯ СВЯЗЬ.

ВОДОРОДНАЯ СВЯЗЬ

Дисперсионное притяжение
В любой молекуле возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. Дисперсионное притяжение В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц.
Для неполярных молекул дисперсное взаимодействие является единственной составляющей ван-дер-ваальсовых сил
Межмолекулярное взаимодействие имеет электростатическую природу.
ОСМОС
Основным оксидам соответствуют основания, кислотным – кислоты,
Амфотерным – и те и другие.
НОМЕНКЛАТУРА
ОКСИД + Э(русское название, род. падеж) + (валентность Э)
Примеры:
MgO– оксид магния
NiO – оксид никеля
Сu2О – оксид меди (I)
Fe2O3 – оксид железа (III)
SO2– оксид серы (IV)
SO3 – оксид серы (VI)
Cl2O7 – оксид хлора (VII)
P2O5– оксид фосфора (V)
2.Опишите способы получения оксидов, приведите примеры химических реакций .
Получение оксидов
1. Взаимодействие простых и сложных веществ с кислородом:
CH4 + 2O2 = CO2 + 2H2O
2Mg + O2= 2MgO
4P + 5O2 = 2P2O5
S + O2 = SO2
2CO + O2 = 2CO2
2CuS + 3O2 = 2CuO + 2SO2
4NH3 + 5O2 = 4NO + 6H2O ( в присутствии катализатора)
2. Разложение некоторых кислородсодержащих веществ (оснований,
кислот, солей) при нагревании:
Cu(OH)2 t= Cu2O↓ + H2O
(CuOH)2CO3 = 2CuO + CO2 + H2O
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2HMnO4 = Mn2O7 + H2O ( в присутствии H2SO4(конц.))
3. Опишите химические свойства оксидов
1. Взаимодействие с водой:
-Основные оксиды-- образуется основание:
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
-Кислотные оксиды-- образуется кислота:
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
