Способы получения кислых солей
Кислая соль –продукт неполного замещения ионов водорода в молекуле многоосновной кислоты ионами металла: NaHS –гидросульфид натрия, Ca(HCO3)2 –гидрокарбонат кальция.
Кислые соли получают:
· действием на кислоту недостатком основания;
H2CO3 + NaOH = NaHCO3 + H2O
недостаток
· взаимодействием кислотного оксида с основанием:
СO2 + NaOH = NaHCO3
· взаимодействием средней соли с кислотой:
Na2CO3 + H2CO3 = 2 NaHCO3;
Na2CO3 + HCl = NaHCO3 + NaCl.
Для перевода кислой соли в среднюю нужно добавить раствор щелочи, чтобы связать ион водорода, присутствующий в составе кислой соли, гидроксогруппой в молекулу воды:
NaHCO3 + NaOH = Na2CO3 + H2O
Способы получения основных солей
Основная соль –продукт неполного замещения гидроксогрупп в молекуле многокислотного основания кислотными остатками: MgOHCl – гидроксохлорид магния, (CuOH)2SO4 –гидроксосульфат меди (II).
Основные соли получают:
· взаимодействием основания с недостатком кислоты:
2Cu(OH)2 + Задание 1= (CuOH)2SO4
· взаимодействием средней соли с основанием того же металла:
Cu(OH)2 + CuSO4 = (CuOH)2SO4
Для перевода основной соли в среднюю нужно подействовать раствором кислоты, для того чтобы связать гидроксогруппу основной соли ионами водорода кислоты в молекулу воды:
MgOHCl + HCl = MgCl2 + H2O
Упражнения
1. Напишите ступенчатую диссоциацию солей: а) гидроксохлорида алюминия, б) дигирофосфата калия, в) гидроксонитрата висмута, г) гидроксохлорида магния, в) гидросульфида бария.
2. С каким из перечисленных веществ будет реагировать сульфат меди (II): а) серой, б) оловом, в) серебром, г) гидроксидом бария, д) оксидом железа (III), е) хлоридом бария?
3. Напишите уравнения реакций, с помощью которых можно получить хлорид магния исходя из следующих веществ: а) магния, б) оксида магния, в) гидроксида магния, г) карбоната магния, д) сульфата магния.
4. Допишите схемы реакций получения солей и составьте уравнения:
MgO + H3PO4 →
Cr2O3 + HNO3 →
CO2 + NaOH →
H2SO4 + … →KHSO4 + …
Fe2(SO4)3 + KOH →
Cu(NO3)2 + Mg →
Fe2(SO4)3 + Ba(NO3)2 →
ЛАБОРАТОРНАЯ РАБОТА
Свойства средних, кислых и основных солей
Приборы и реактивы: 2н растворы соды, серной и соляной кислот, гидроксидов натрия и калия, сульфата меди, хлорида аммонии, хлорида бария, хлорида висмута (III), пробирки, спиртовка, индикаторная бумага.
Опыт 1. Получение летучей кислоты из соли.
К 1 мл раствора карбоната натрия прибавить по каплям раствор соляной или серной кислоты. Что наблюдается? Какая кислота образуется? Написать уравнение реакции в молекулярной и ионной формах.
Опыт 2. Получение основания из соли.
К 1 мл раствора сульфата меди прилить по каплям раствор гидроксида натрия или калия. Что наблюдается? Написать уравнение реакции в молекулярной и ионной формах.
Опыт 3. Получение летучего основания из соли.
К 1 мл раствора хлорида аммония прилить 0,5 мл раствора гидроксида натрия и содержимое пробирки нагреть. Над пробиркой держать полоску индикаторной бумаги, смоченной дистиллированной водой. Что наблюдается? Написать уравнение реакции в молекулярной и ионной формах.
Опыт 4. Взаимодействие солей.
К 1 мл раствора хлорида бария прилить 1 мл раствора сульфата натрия. Что наблюдается? Написать уравнение реакции в молекулярной и ионной формах.
Опыт 5. Получение основной соли висмута (III).
К 1 мл раствора хлорида висмута добавить 3 – 4 мл воды. Образуется белый осадок основной соли висмута (гидроксохлорида висмута). К образовавшемуся осадку прилить несколько капель соляной кислоты. Что наблюдается? Написать уравнения реакций в молекулярной и ионной формах.
Стехиометрические законы
Вопросы для подготовки к занятию
1. Понятие химический элемент. Простое и сложное вещество. Определение относительных атомных и молекулярных масс. Основные положения атомно-молекулярного учения.
2. Количество вещества, моль. Молярная масса.
3. Закон сохранения массы веществ. Расчеты по уравнениям химических реакций.
4. Закон Авогадро. Молярный объем. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
5. Химический эквивалент. Молярная масса эквивалента. Фактор эквивалентности. Закон эквивалентов.
Простые вещества состоят из атомов одного химического элемента. Они делятся на металлы и неметаллы. Металлы- натрий Na, серебро Ag, алюминий Al, и т.д. Это вещества с металлическим блеском, ковкие, пластичные, тепло и электропроводные. Неметаллы – сера S8, кислород О2 , йод I2 и т.д. у них отсутствуют металлический блеск, они хрупкие, плохо проводят электрический ток и теплоту.
Сложные вещества состоят из атомов нескольких химических элементов. Р2О5 оксид фосфора (V), H2SO4 серная кислота, NaCl соль – хлорид натрия и т.д.
Химический элемент – это вид атомов с одинаковым зарядом атомного ядра. Вид атомов с зарядом ядер +1 – это химический элемент водород. В настоящее время открыто и искусственно получено 110 химических элементов. Они делятся на металлы (Na, Ca, Mg и т.д.), неметаллы (F, O, S, и т.д.) и переходные элементы (Zn, Al, Pb и т.д.). каждый химический элемент имеет условное обозначение: химический знак, он состоит из одной или двух букв латинского алфавита. Эти буквы являются первой и последующей буквой латинского названия элемента.
Н (аш) – водород, Hydrogenium.
Аg (аргентум) – серебро, Argentum.
Каждый химический элемент имеет своё название. Названия у химических элементов не случайные.
Атомные и молекулярные массы. Их выражают в атомных единицах массы (а.е.м.). В настоящее время за атомную единицу массы принимается 1/12 часть массы атома углерода – 12 (изотоп 612С), что составляет 1,66*10-27 кг. Чтобы рассчитать относительную массу атома, надо найти отношение массы атома к 1/12 части массы атома углерода-12. Например, масса атома изотопа фтора 19F равна 3,1553*10-26 кг. Тогда относительная атомная масса этого атома Ar (19F) составит: Ar(19F)= 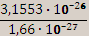 =18,998.
=18,998.
Относительную молекулярную массу Мr можно рассчитать, сложив относительные атомные массы Ar элементов, из которых состоит молекула, с учетом числа атомов, входящих в молекулу. Mr (H2SO4) = 1*2+32+16*4=98. Для веществ с кристаллической (немолекулярной) структурой относительную молекулярную массу рассчитывают для условной молекулы, состав которой соответствует простейшей формуле.
Моль. Одной из основных физических величин является количество вещества. В соответствии с международной системой единиц (СИ) единицей количества вещества, измерения, служит моль. Моль-количество вещества, которое содержит столько структурных единиц (т.е. атомов, молекул, ионов, электронов), сколько содержится атомов в 12 г изотопа углерода – 12.
Постоянная Авогадро. – это постоянная величина NA=6,02*1023 моль-1. Число атомов в 12г 12С равно 6,02*1023. Постоянная Авогадро показывает число структурных единиц в одном моле любого вещества.
Молярная масса- это отношение массы вещества к его количеству.
М (в-ва) = 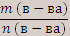 . Единица СИ молярной массы- кг/моль или г/моль.
. Единица СИ молярной массы- кг/моль или г/моль.
Молярная масса вещества (в г/моль) численно равна относительной атомной или молекулярной массе этого вещества. Mr (H2SO4) = 98.
М (H2SO4) = 98 г/моль.
- Закон сохранения массы веществ
Этот закон открыт в 1756 г. русским ученым М.В. Ломоносовым.
« Масса веществ вступивших в химическую реакцию равна массе веществ получившихся в результате химической реакции».
М.В. Ломоносов прокаливал металлы в реторте (запаянный сосуд) и обнаружил, что вес веществ до и после реакции остался неизменным. Открытие этого закона способствовало развитию химии, как науки; утверждению атомно-молекулярного учения; на основании этого закона составляются уравнения химических реакций и по ним проводятся важные расчеты.
- Закон постоянства состава веществ. Открыт в 1779 г. Французским химиком Ж. Л. Прустом. «Состав любого химически чистого вещества постоянен независимо от способа получения и места нахождения».
Согласно этому закону вещества вступают в химические реакции в определенных массовых отношениях.
Fe + S  FeS
FeS
56г 32г  88 г./ сократим на 8.
88 г./ сократим на 8.
7г : 4г 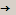 11г.
11г.
Берем 8г + 4г 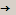 11г FeS и 1г Fe в остатке.
11г FeS и 1г Fe в остатке.
Берем 7г + 5г 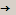 11г FeS и 1г S в остатке.
11г FeS и 1г S в остатке.
Этот закон дал химикам возможность выражать состав веществ при помощи химических формул: Н2О вода, СО2 углекислый газ и т.д. состав веществ определяется экспериментально.
- Закон Авогадро. Открыт итальянским ученым Авогадро.
«в равных объёмах любых газов при одинаковых внешних условиях (температуре и давлении) содержится одинаковое число молекул.»
Следствие из закона Авогадра:
« 1 моль любого газа при постоянных условиях всегда занимает один и тот же объем».
«1 моль любого газа при нормальных условиях (00 С или 2730 К и Р = 101,325 кПа) занимает объем 22,4 л.»
Постоянная 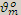 =22,4 л/моль называется молярным объёмом газа при н.у.
=22,4 л/моль называется молярным объёмом газа при н.у.
Из закона Авогадро следует, что если объемы двух газов при постоянных условиях равны, то и равно число молекул двух газов.
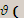 1 газа) =
1 газа) = 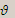 (2 газа) при постоянных условиях.
(2 газа) при постоянных условиях. 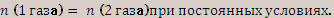 отсюда,
отсюда,
D газа1 / газу2= 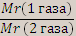
D – относительная плотность одного газа по второму. При расчетах чаще всего пользуются относительными плотностями газов по водороду Dн2 и по воздуху Dвоздуха, их определяют экспериментально и по ним вычисляют относительную молекулярную массу газа.
- Закон эквивалентов.
« Массы элементов и веществ, участвующих в химических реакциях, относятся друг к другу, как их эквиваленты».
Математическое выражение закона эквивалентов: m1 : m2= э1 : э2 или m1: э1= m2 : э2.
Отсюда: 1) элементы и вещества участвуют в химических реакциях в одинаковых количествах их эквивалентов; 2) масса элемента или вещества в граммах, численно равная эквиваленту, называется грамм-эквивалентом.
Величина эквивалента зависит от типа и характера химической реакции, в которой участвует данный элемент или вещество.
Эквивалентом вещества называется некоторая условная частица этого вещества, которая в данной реакции соединяется с одним атомом или ионом водорода либо замещает его.
Ca(OH)2 + 2 HCl 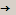 CaCl2 + 2 H2O
CaCl2 + 2 H2O
В этой реакции одному иону водорода эквивалентна условная частица, равная ½ Са(ОН)2. Это и будет эквивалентом гидроксида кальция. Число1/2 носит название фактора эквивалентности: f эквивалента. [ Са(ОН)2]=1/2
Молярная масса эквивалента вещества вычисляют по формуле:
М эквивалента. [ Са(ОН)2]= f экв. * М =1/2 * 74 г/моль=37г/моль.
Количество вещества эквивалента – это отношение массы вещества к молярной массе эквивалента вещества.
N экв. (в-ва) = 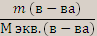 , если m [ Са(ОН)2]=100 г ,
, если m [ Са(ОН)2]=100 г ,
то n экв. [ Са(ОН)2]= 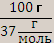 =2,7 моль.
=2,7 моль.
Упражнения
1. 250 мл неизвестного газа, взятого при нормальных условиях, имеют массу 0,357 г. Определить молярную массу газа.
2. Определить молярную массу газа, если его плотность по воздуху равна 0,965.
3. Определить плотность хлора по водороду и кислороду, если масса 1 л его при н.у. 3,16 г, масса 1 л водорода 0.089 г и 1 л кислорода - 1,43 г.
4. 100 г газа при 47° С и давлении 405.2 кПа занимает объем 41 л. Найти молекулярную массу газа.
5. Найти эквивалент металла, если его оксид содержит 79,9% металла и 20,1% кислорода.
6. При соединении 4,5 г трехвалентного металла с серой образовалось 12,5 г сульфида этого металла. Определить эквивалентную массу и название металла.
7. Найти эквивалентные массы следующих веществ: HCl, H2SO4, KOH, Cu(OH)2, FeCl3, Al2(SO4)3, Na2O, P2O5.
8. Неизвестный газ имеет относительную плотность по воздуху 1,31. Определите массу образца этого газа объемом 168 л.
9. Замкнутый сосуд с оксидом серы (IV) содержит при нормальных условиях 2,1·1022 молекул. Определите вместимость сосуда и массу находящегося в нем газа.
10. Вычислите относительную плотность по водороду газовой смеси, состоящей из оксида углерода (II) объемом 56 л и оксида углерода (IV) объемом 28 л.
