Значение периодического закона
1. Периодический закон способствовал развитию науки и открытию новых элементов;
2. Периодический закон подтвердил общие законы развития природы:
a) Закон перехода количества в качество (изменение металлических и неметаллических свойств);
b) Закон единства и борьбы противоположностей (строение атома, амфотерные соединения);
c) Закон отрицания отрицания (развитие по спирали, переход от периода к периоду).
3. Периодический закон явился первоисточником всех открытий химии и физики в XX веке.
Вопрос №2
Строение атомов химических элементов
Вопрос №3
Химические связи
Различают несколько типов химических связей: 1 – ионная. Ионная связь образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности (связь между типичным металлом и типичным неметаллом).
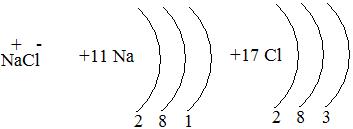
Na0-1e = Na+ Cl0+1e = Cl—
Ионная связь характерна также для щелочей и солей, в которые входят кислород и активные металлы.
2 – ковалентная связь образуется при перекрывании электронных облаков.
Ковалентная неполярная образуется при взаимодействии атомов с одинаковыми электроотрицательностями.
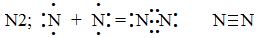
Ковалентная полярная образуется при взаимодействии атомов, электроотрицательности которых различаются незначительно.

3 – металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке. Атомы металла легко отдают валентные электроны и превращаются в положительные ионы. Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке.
4 – водородная связь – это связь между атомом водорода одной молекулы и атомом сильного электроотрицательного элемента другой молекулы.
Водородная связь – это молекулярная связь. Она слабее, чем ионная и ковалентная связь.
Простые и кратные связи
Простые связи имеют элементы, у которых имеется одна связь. Кратные, – у которых имеются две, три связи.
Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется простой (одинарной) связью.
π-Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.
s-Облака не могут образовать π-связи. В образовании π-связей могут участвовать p- и d-облака. Например, π-связь образуется при перекрывании двух p-облаков.
π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары.
Число общих электронных пар между связанными атомами характеризует кратность связи.
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью. Любая двойная связь состоит из одной σ-связи и одной π-связи.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Любая тройная связь состоит из одной σ-связи и двух π-связей.
Двойные и тройные связи имеют общее название: кратные связи.
Вопрос №4
