Вычисление эквив-ов простых и сложных в-в.
Закон эквивалентов.
Эквивалентом в-ва наз-ся такое его кол-во,¡ взаимодействует с 1 молем атомов водорода или вытесняет такое же кол-во атомов водорода в хим-их р-ях.
HCl ЭCl=1; H2O Э0=1/2; NH3 Э n=1/3
Масса 1 эк-та наз-ся эк-ной массой (Э)
 , В-валентность
, В-валентность
NO  г/моль
г/моль
Закон эквивалентов: в-ва реагируют м/у собой в эквив-ых кол-вах.
Вычисление эквив-ов простых и сложных в-в.
Эквивалентом в-ва наз-ся такое его кол-во,¡ взаимодействует с 1 молем атомов водорода или вытесняет такое же кол-во атомов водорода в хим-их р-ях.
Эквив-ая масса в-ва = сумме эквив-ов, состав-щих данное в-во элементов.

 , где
, где
В - валентность элемента
r-число атомов элемента


Основность кислоты опр-ся кол-вом атомов водорода, вступивших в реакцию.
H2SO4+2NaOH ÞNa2SO4+2H2O
ЭH2SO4=98/2=49г/моль
 Кислотность осн-ия опр-ся кол-вом гидроксильных групп, всткпивших в реакцию
Кислотность осн-ия опр-ся кол-вом гидроксильных групп, всткпивших в реакцию
Al(OH)3+3HClÞAlCl3+3H2O

Al(OH)3+HClÞAl(OH)2Cl+H2O


(знаменатель-фактор эквивалентности (f))

Моль
моль–кол-во в-ва,содержащее столько структурных единиц (атомов, молекул, ионов),ск-ко атомов содержится в 0,012кг изотопа углерода 126С.Масса 1 моля данного в-ва- это его молярная масса, g измеряется в г/моль или кг/моль. Молярная масса = отношению массы в-ва к кол-ву в-ва(М=m/n).Молярная масса серной кис-ты МН2SO4=98г/моль.
Закон Авогадро
В равных объёмах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул.
Закон Авогадро позволил сделать выводы о числе атомов в молекулах газов например, таких, как H, Cl, O, N. Закон применим и для заряженных частиц в газовой фазе (электронов, ионов), если их концентрация невелика, а воздействием магнитных и электрических полей можно пренебречь.
Мольный объём газа.
Моль–кол-во в-ва, содержащее столько структурных единиц (атомов, молекул, ионов),ск-ко атомов содержится в 0,012кг изотопа углерода 126С.
Молярная масса газа=его плотности по отношению к др. газу, умноженной на молярную массу второго газа(М1=D*M2).Молярный обьём газа- (м3/моль, л/моль)-отношение обьёма в-ва к кол-ву этого в-ва(Vm=V/n).При н.у. Молярный обём газа=22,4л/моль
Эквивалент окислителя и восстановителя.
В окислительно-восстановительных реакциях значения эквивалентного числа окислителя и восстановителя определяют по числу электронов, которые принемает ФЕ окислителя или принимает 1 ФЕ восстановителя.
Еслии известно количество вещества, то количество вещества эквивалентов всегда в число эквивалентности раз больше (или равно) количества веществе:
nэк(В) = zв • nв (2)
В практических расчетах наиболее часто пользуются молярной массо! экви-валенто в. Молярной массой эквивалентов вещества В называется отюшение массы вещества В к его количеству вещества эквивалентов:
МЭК(В)= mв/nэк(В).
Учитывая при этом соотношения (1) и (2), получается другая формула*
МЭК(В) | Мв/zb
Электронное облако.
Если бы в каждый момент времени опр-ли положение электрона в трехмерном прост-ве и ставили в том месте точку, то ч/з мн-во таких определений получили бы картину в виде прост-венного облака изображенного точками с размытыми краями .Это зарядовое облако-электронное облако.Его плотность яв-тся непосредственной мерой вероятности нахождения электрона. Граничная поверхность облака, внутри g содержится 90–95% электронного заряда, дает форму орбитали.
Электронная орбиталь.

 В основе современного понимания микромира лежит представление о том, что электрон обладает св-ми частицы и св-ми волны. Быстро движущийся электрон м. находится в любой точке пространства, окруж-ей ядро.
В основе современного понимания микромира лежит представление о том, что электрон обладает св-ми частицы и св-ми волны. Быстро движущийся электрон м. находится в любой точке пространства, окруж-ей ядро.
По мере удаления электрона от ядра плотность возрастает и достигает макс-го значения на расстоянии 0,53А, дальше этого расстояния электронная плотность уменьшается.
Область, в g заключено 90% вероятности нахождения электрона наз-ся электронной орбиталью (ЭО).ЭО наз-ся также электронным слоем или энергетическим уровнем. Электроны в атоме располагаются энергетическими уровнями, g находятся на опр-ом расстоянии от ядра и друг от друга. Нахождение электронов опр-ся системой квантовых чисел.
Элементов.
Изменение свойств химических элементов по мере возрастания их атомной массы не совершается непрерывно в одном и том же направлении, а имеет периодический характер.
Сродство атома к электрону
 Энергия, поглощаемая или выделяющаяся при присоединении электрона к атому, иону, радикалу или молекуле в газовой фазе при T = 0 K без передачи частице кинетической энергии, называется сродством атома к электрону. Сродство к электрону, как и энергия ионизации, обычно выражается в элёктрон вольтах и обозначается Ее. Сродство к электрону атома водорода равно 0,75 эВ. кислорода — 1,47 эВ, фтора — 3,52 эВ.
Энергия, поглощаемая или выделяющаяся при присоединении электрона к атому, иону, радикалу или молекуле в газовой фазе при T = 0 K без передачи частице кинетической энергии, называется сродством атома к электрону. Сродство к электрону, как и энергия ионизации, обычно выражается в элёктрон вольтах и обозначается Ее. Сродство к электрону атома водорода равно 0,75 эВ. кислорода — 1,47 эВ, фтора — 3,52 эВ.
3.4 ЭлектроотрицательностьДля оценки способности атома данного элемента оттягивать к себе общую электронную плотность пользуются величиной относительной электроотрицательности, обозначаемой греческой буквой X.Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару. У элементов одной и той же подгруппы электроотрицательность с ростом числа электронных оболочек проявляет тенденцию к уменьшению. Таким образом,чем более типичным металлом является элемент, тем ниже электроотрицательность; чем более типичным неметаллом является элемент, тем выше его электроотрицательность.Смещение общего электронного облака при образовании полярной ковалент-ной связи приводит к тому, что средняя плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже — вблизи менее электроотрицательного. B результате первый атом приобретает избыточный отрицательный, а второй — избыточный положительный заряд; эти заряды принято называть эффективными зарядами атомов в молекуле.
3.5 Энергией ионизации называется энергия, необходимая для удаления электрона из атома, иона, радикала или молекулы в газовой фазе при T = 0 K без передачи освобожденному электрону кинетической энергии.Обозначают энергию ионизации символом Еи, выражают в Дж, кДж или электрон-вольтах (эВ). 1 эВ — энергия, которую приобретает электрон в ускоряющем электрическом поле с разностью потенциалов 1 B (1 эВ = 96,5 кДж/моль).потенциалом ионизации называетсянаименьшее напряжение поля, при котором скорость электронов становится достаточной для ионизации атомов, и выражается в вольтах.
4.1. Метод валентных связей. (м. в. с.) В основу м. в. с. лежит исследования англ-их учёных Гейтлера и Лондона. Их исследования проводились на атоме Н.Образовалась общая электронная пара, ¡ принадлежит обоим атомам.В основе м. в. с. лежат следующие положения: 1. ковалентная хим-ая связь образуется 2 электронами, с противоположенно направленными спинами. 2. ковалентная связь тем плонтее, чем в большей степени происходит перекрытие электронных облаков. 4.2. Обменный и донорно – акцепторный механизм образования химической связи.Атом предоставляющий электрону пару является донором, принимающий – акцептором. Атом предоставляющую электронную пару является донором, принимающий – акцептором. 4.3 Основные харак-ки хим-ой связи. 1. длина.связи L опр-ет расстояние м/у ядрами взаимодействующих атомов. 2. кратность связи – опр-ся кол-вом электронных пар, связывающим 2 атома. 3. направленность. δ, π
 Если область перекрывания лежит на прямой, соединяющей взаимодействующие ядра атомов – это δ связь. Если обл. перекрыв. лежит выше или ниже прямой, соед-щий ядра атомов, это π связь. 4. дипольный момент. Если мелекула обр. атомами одного эл-та, то они будут в одинаковой степени притягивать общ. электроную пару. 5. энергия связи – это энергия, γ выделяется при образовании молекулы из одиноч. атомов. 4.4. Энергия ионизации и сродства к электрону.
Если область перекрывания лежит на прямой, соединяющей взаимодействующие ядра атомов – это δ связь. Если обл. перекрыв. лежит выше или ниже прямой, соед-щий ядра атомов, это π связь. 4. дипольный момент. Если мелекула обр. атомами одного эл-та, то они будут в одинаковой степени притягивать общ. электроную пару. 5. энергия связи – это энергия, γ выделяется при образовании молекулы из одиноч. атомов. 4.4. Энергия ионизации и сродства к электрону.
Энергия ионизации – энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Увеличивается с ростом порядкового номера возрастает в периоде и уменьшается в подгруппах.
Атомы м. не только отдавать, но и присоединять электроны. Энергия, поглощаемая или выделяющаяся при присоединении электрона к атому, иону без передачи частице кинетической энергии наз-ся сродством атома к электрону.
4.5. Электроотрицательностьопр. в какой степени общая электр. пара смещается к тому или иному атому. Электроотриц. рассчитывается по сумме энергии ионизации и сродства к электрону. Энергия ионизации – энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Увеличивается с ростом порядкового номера возрастает в периоде и уменьшается в подгруппах.
Атомы м. не только отдавать, но и присоединять электроны. Энергия, поглощаемая или выделяющаяся при присоединении электрона к атому, иону без передачи частице кинетической энергии наз-ся сродством атома к электрону. самый электроотриц. элемент – это фтор.
Ионная связь.
Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами. Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия(NaOH) и сульфате натрия(Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).Ионная связь.Предельным случаем полярной ковалентной связи является ионная связь. Ионная связь в «чистом» виде не существует, так как в любой химической связи всегда имеется та или иная доля ковалентного характера.
Экзо- и эндотермич. р-ции.
Разность энергий образующихся связей и тех, γ претерпели разрыв проявл-я в виде результирующего теплового эффекта хим. р-ций.
Хим. р-ции, сопровождающиеся выделение тепла наз-ся экзотермическими, р-ции
сопровождающиеся поглащением тепла – эндотермическими. В ходе экзотермич. процессов система теряет тепло, поэтому в экзотермич. р-ях тепловой эффект со знаком (-), в эндотермич. – со знаком (+)
5.4. Теплота образования.
Разность энергий образующихся связей и тех, γ претерпели разрыв проявл-я в виде результирующего теплового эффекта хим. р-ций. Тепловой эффект, соответствующий образованию 1 моля в-ва из устойчивых стандартных условий простых в-в наз-ся теплотой образования данного в-ва. При образовании хим. соединений поглащается или выделяется такое кол-во теплоты, какое выделяется ли поглащается при его разложении на первоначальные составные части.
Энтальпия.
Разность энергий образующихся связей и тех, γ претерпели разрыв проявл-я в виде результирующего теплового эффекта хим. р-ций.
Тепловой эффект хим. р-ций показывает изменение теплосодержания системы и наз-ся энтальпией (Н). Энтальпия простых в-в=0.
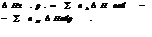
5.6. Закон Гесса.
Важнейшим законом, лежащим в основе термодинамич
вычислений я-я закон Гесса (или закон суммы тепловых эффектов). Этот закон утверждает, что тепловой эффект хим. р-ции зависит не от его пути, а от начального и конечного состояния.
1.С+О2=С О2
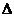 Н=-393,5 кдж/моль
Н=-393,5 кдж/моль 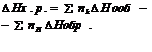
5.7. Энтропия (S)харак-ет возможное состояние в-ва и их постоянные изменения. Любому состоянию в-ва, взятому при опр. условиях отвечает большое разнообразие микросостояний. Это обусловлено тем, что частицы в-ва находятся в непрерывном колебательном движении, переходя из одного состояния в др. Энтропияотносят к 1 молю в-ва. Значение энтропии будет зависить от агрегатног состояния в-ва
Sг>>Sж>>Sт S измеряется в энтропийных единицах, Дж/моль*град. Значение энтропии зависит и от аллотропной модификации в-ва Sал=2,58 э.е.
Sгф=5,73 э.е. Значение энтропии зависит от сложности молекул Sco2>Sco на 16,2 э.е.
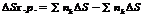
Энергия Гиббса.
Движущая сила хим. р-ции опр-ся изменением свободной энергией системы, т.е.
той части её общего теплосодержания, γ м.б. исп-на для совершения макс-ной работы, еёё опр-ют при постоянных температуре и давлении и наз-ют энергией Гиббса (G)
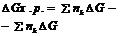 (Н.У)
(Н.У)
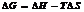
Концентрация р-ов.
Процентная концентрация (массовая доля ω) опр-ет массу растворенного в-ва в массе р-ра.

Молярная концентрация (СМ) показывает содержание кол-ва молей растворенного в-ва, приходящегося на 1 литр р-ра.

Нормальная (эквивалентная) концентрация опр-ся кол-вом эквивалента растворенного в-ва, приходящегося на 1 литр р-ра. (СН).

Моляльная концентрация. (Сm) хар-ет кол-во растворенного в-ва, приходящееся на массу растворителя.

Ионное произведение воды.
Для воды и разбавленных водных р-ров при неизменной температуре произведение концентраций Н и ОН ионов есть величина постоянная, она наз-ся ионным произведением воды.
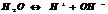
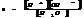
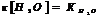
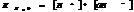
При 250С 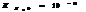
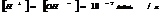
7.13. Водородный показатель.
Кислотность или щёлочность разбавленных р-ров м. выразить так: вместо концетрации ионов Н+и ОН- (ионное произведение воды) указывают её десятичный логарифм, взятый с обатным знаком – это наз-ся водородным показтелем и обозначается рН.
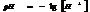
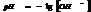
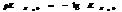
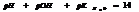
нейт. среда рН=рОН=7
кисл. pH<7
щёлоч. pH>7
7.14. Произведение растворимости.
В насыщенном р-ре электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Эта величина кол-но характеризует способность электролита растворяться, её наз-ют произведением растворимости. 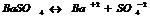
осадок р-р.
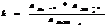
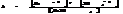
Произведение растворимости:
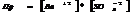
7.15. Условие образования и растворения осадка.
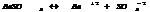
осадок р-р.
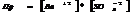
Если 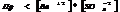 , то образуется осадок, если
, то образуется осадок, если 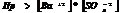 , то происходит растворение.
, то происходит растворение.
Ступень
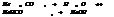
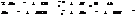
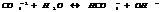
Ступень
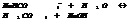
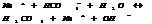
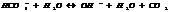 2. соли, обр-ые слабыми электролитами основаниями многовалентных Ме.
2. соли, обр-ые слабыми электролитами основаниями многовалентных Ме.
Ступень
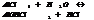
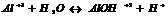 2. ступень
2. ступень
 3. ступень.
3. ступень.
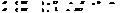
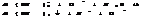
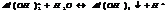
Составление ур-ний р-ций.
1. метод электронного баланса.
2. метод полуреакции.
По методу электр. баланса: кол-во электронов, отданное в-лем должно= кол-ву электронов, принятых ок-лем. Этот метод исп-ся, если известны все продукты р-ции.
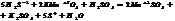 S-2-2 =S0 5ок-ся, в-ль H2S
S-2-2 =S0 5ок-ся, в-ль H2S
Mn+7+5 =Mn+2 2 в-ся, о-ль KMnO4
Метод полур-ции исп-ся, если известны не все продукты р-ции, составляют отдельно р-ции ок
ния и восст-ия, γ суммируются в сокращённое ионно-молекулярное ур-ние.
H2S-2 =S+2H+ 5
+
MnO4-+8H++5 =Mn+2+4H2O 2
5 H2S+2 MnO4+16H=5S+10H+2Mn++8H2O
+
3SO4-2+K+ 2K++SO4-
8.5. Зависимость ок-но-восст-ых св-в от степени окисления Соединения высшей степени окисления, присущей данному эл-ту, м. в ок-но-восст-ых р-ях выступать только в качестве ок-лей, СО эл-та м.в этом случае только понежатся. Соединения низшей СО м.б., наоборот, только восст-ми; здесь СО эл-та м. только повышаться. Если эл-т находится в промежуточной СО, то его атома м. в зависимости от условий, как принимать, так и отдавать электроны. В первом случае СО эл-та будет понижаться, во втором – повышаться. Поэтому соединения, содержащие эл-ты в промежуточной СО, обладают ок-но - восст-ной двойственностью – способностью вступать в р-ции как с ок-ми, так и восст-ми.
3S0+6KOH=K2S+4O3+2K2S-2+H2O
S0-4 = S+4 1 ок-ся, в-ль
S0+2 = S-2 2 в-ся, ок-ль
Электролиз
Электролизом называется совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию. На катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом.Инертнымназывается анод, материал которого не претерпевает окисления в ходе электролиза. Активнымназывается анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину. Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом.
Номенклатура КС.
1. КС неэлектролиты.
для наименования КС принята след. последовательность:
1.указать число и нименование нейтральных молекул: Н2О – аква, NH3 – амин, N2H3 – гидрозин.
2. указываются (-) заряженные лиганды: О-2 – оксо; ОН- - гидро; NO2- - нитро; SO3-2 – сульфито.
3. указывается название комплексообразователя, без указания его степени окисления.
акватрифторакобальт.
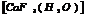
диамминтетрахлороплатина.
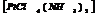
2. КС с комплексным катионом.
Сначала указ-ся комплексный катион, затем внешнюю сферу. Последовательность наимен-ния лигандов сохр-ся, к наименованию комплексообразователя добавляется степень окисления.
тетраамминдихлораплатина (3) хлорид.
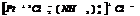
тетраамминмедь(2) гидроксид.
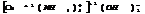
3. КС с комплексныи анионом.
В начале называют внешнюю сферу (катион), а потом внутреннюю (анион). Комплексообразователю придают окончание –АТ.
барий диамминтетрароданохромат (3)
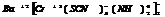
калий тетраброминат (2)
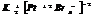
4. КС с комплексными катионом и анионом.
гексаамминкобальтат(3) гексанитрокобальтат(3)
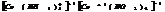
тетраамминкобальт(2) тетрахлораплатинат(2)
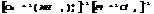
Равновесие в растворах КС.
Большинство КС растворимы в воде, при растворении они диссоциируют в основном с обр-ем комплексного иона. Т.к процесс р-ции обратимый, то равновесие м. нарушить удалив из системы 1 из продуктов р-ции.
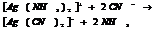
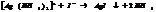
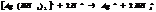
10.7. Константы нестойкости КС.
Большинство КС растворимы в воде, при растворении они диссоциируют в основном с обр-ем комплексного иона.
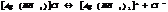
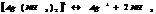
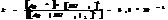
Константа диссоциации КС наз-ся константой нестойкости.
11.1. Положение Ме в ПС Менделеева.
Все элементы подразделяются на Ме и не Ме (не Ме – 22, Ме – 85). К Ме относятся все s, d, f – эл-ты p – как Ме, так и не Ме. Большинство Ме содер-т на последнем эл-ом уровне по 1 и 2 электрону. Эл-ты Ме обр-ют в-ва с тем же наз-ем. В обычных усл-х это кристал. в-ва (искл. Hg).
Металлическая связь.
Ме связь обр-ся за счёт свободного перемещения электронов последнего энергетического уровня по всему V Ме.
Пр.: Na 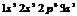
NA=6,02*1023
NA-число Авагадро.
Ме связь хар-на для Ме в тв-ом и в жидком состояниях. В газообразном состоянии для Ме хар-на ковалентная связь.
Все физ-ие св-ва Ме объясняются Ме связью.
11.3. Типы кристаллических решеток.
Наиболее типичными я-я 3 кристаллические решетки:
1.объёмно – центрированная кубическая решётка, в такой струк-е каждый атом Ме попадает в центр куба, γ обр-ют 8 соседних атомов (Na, Cr)2. гранецентрированная куб-ая решётка, она обр-на 14 атомами (8 на вершине куба, 6 н грагнях). Al, Ni
3. гексагональная плотно упакованная решётка (Mg, Co).
11.4. Физ-ие св-ва.1. высокая пластичность. Атомная красталич. решётка
ионная решётка
2. для всех Ме хар-ен Ме блеск, обычно серый цвет и не прозрачность. Непрозрачность Ме обусловлена присутствием в кристал-й решётке свободных электронов. Свободные электроны гасят световые колебания, превращая их в теплоту или в некоторых случаях для фотоэлектрического эффекта. Ме блеск объясняется тем, что Ме отражают большую часть, падующего на них света. Интенсивность блеска опр-ся долей поглащаемого цвета, большинство Ме практически полностью отражают падающий на них свет, поэтому имеют белый или серый цвет. Наиболее ярко блестят Pl и Ag. Au, Cu, цезий поглощают в большей степени зелёный и голубой цвет, поэтому имеют жёлтый или красный цвет. Хорошая электропроводность Ме объясняется присутствием свободных электронов, γ под влиянием даже небольшой разности потенциалов, приобретают направленное движение. С повыш-ем темпер-ры усиливается колебательное движение атомов, что затрудняет направленное движение электронов, витая электропроводность умен-ся и наоборот. Наибольшей электропро-ю обл-ют Ag и Cu, затем Au, Al, Fe. У неМе с повешением toC электропров-ть возрастает, это объясняется тем, что число свободных электронов увелич-я за счёт разрыва ковалентных связей. При низких toC неМе не обладают электропров-ю из-за отсутствия свободных электронов. В этом состоит гл. различие Ме и неМе. Различна плотность (ρ) Ме, она тем меньше, чем меньше атомная масса и больше радиус эл-та. Наим-ей ρ обладает Li, его ρ=0,56 г/см3. Самый тяжёлый Ме Os ρ(Os)=22,6 г/см3. Различны toC плавления и кипения Ме. Самый легкоплавкий Hg toC плавления =38,9 С0, тугоплавкий вольфрам=3390 С0. Ме с toC плавления до 10000С наз-ся легкоплавкими. Сильное различия в toC плавления и кипения объясняется тем, что прочность хим. связи в Ме различна. В чистом виде Ме связь хар-на только для щелочных и щелочноземельных Ме. У остальных Ме (особенно d-Ме) наблюдается возникновение ковалент. связи, она намного прочнее Ме-ой, поэтому d-Ме обладают большей toC плавления и кипения. Ме отличаются по твердости. Самый твёрдый-Cr, лёгкий-K, Ru, Cs.
Хим-ие св-ва Ме.
Хим-ая активность Ме различна. Щелочные, щелочноземельные – самые активные, вступают в р-ции при обычных условиях. Самые устойчивые Au, Pt не взаим-ют даже с сильнейшими окислителями. Хим-ая активность многих Ме снижается из-за образования на их пов-ти тонких защитных плёнок, эти защитные плёнки препятствуют проникновению окислителей к пов-ти Ме.
Ме реагируют с:
1.с неМе, в рез-те образуются бинарные соединения.
2. с О2 образуя оксиды, γ м. проявлять основный, амфотерный и кисл. хар-р.
3. с МЕ, обр-ся интермет-ие соединения (MgZn, Cu5Zn8).
Некоторые интермет-ие соединения м.б. различного состава (AgZn, Ag2Zn, Ag5Zn8)
интермет-ий соединения по внешнему виду похожи на Ме. По св-ам они значительно отлич-ся от св-в исходных Ме. Mg toC плавления 651oC, взаимодейст. с оловом, toC плавления 232oC. В рез-те обр-ся Mg2Sn, toC плавления 748oC, электропроводность в 80 раз меньше, чем у олова, и в 220 раз меньше, чем у Mg.
4. с Н20. С Н20 м реагировать Ме, стоящие до Н2. Активные Ме реагируют активно в н.у.
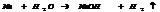
Ме с меньшей Активностью
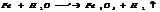
5. со щелочами. Ме, оксиды и гидроксиды, γ обладают амфотер. св-ми м. взаим-ть со щелочами
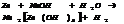
6. с кисл.
HCl на Ме, имеющие постоянную СО разбавленная и конц. кисл. дейт-т одинаково, обр-ся хлорид и газ 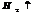
Если Ме имеет переменную СО, то глубина его окисления зависит от концентрации кисл., чем больше концентрация, тем больше окисления у Ме
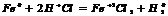
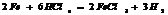
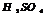 разб. реагирует с Ме, стоящими до
разб. реагирует с Ме, стоящими до 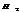 , в пез-те обр-ся сульфат и
, в пез-те обр-ся сульфат и 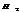 .
.
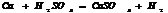
Конц. 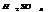 реагирует с Ме, стоящими до Ag включительно, в зависимости от активности Ме обр-ся различ. продукты
реагирует с Ме, стоящими до Ag включительно, в зависимости от активности Ме обр-ся различ. продукты 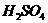 - SO2; S; H2S, также обр-ся сульфат и вода.
- SO2; S; H2S, также обр-ся сульфат и вода.
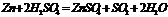
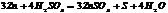
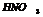 реагирует со всеми Ме кроме благородных.
реагирует со всеми Ме кроме благородных.
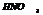 (к) не дейст. на Fe, Cr, Al, Au, Ir, Pt, Ta.
(к) не дейст. на Fe, Cr, Al, Au, Ir, Pt, Ta.
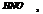 (к)+тяжёлые Ме= NO2
(к)+тяжёлые Ме= NO2
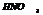 (к)+щелочные, щелочноземельные Ме=N2O
(к)+щелочные, щелочноземельные Ме=N2O
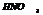 (р)+тяж. Ме=NO
(р)+тяж. Ме=NO
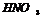 (р) щелочные, щелочноземельные Ме, Zn, Fe=NH3, NH4NO3
(р) щелочные, щелочноземельные Ме, Zn, Fe=NH3, NH4NO3
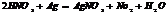
Металлы и их соединения.
1. Общая характеристика подгрупп. Физические свойства
IА - Li, Nа, К, PЬ, Сs, Fr IIА - Ве, Мg Са, Sr, Ва, Rа
Все элементы групп IА и IIА являются металлами. Металлы группы IА имеют серебристую окраску, но быстро тускнеют на воздухе. У них сравнительно слабая металлическая связь, т.к. имеется только один валентный электрон. Они во многом отличаются от других металлов, а именно: они мягкие и их можно резать ножом; у них низкие температура плавления и кипения; значения стандартных энтальпий плавления и испарения низкие; у них малые плотности (Li, Na, К - легче воды).
У металлов группы IIА два валентных электрона и более прочная металлическая связь, что отражается на их физических свойствах.
Металлы группы IА имеют объёмноцентрированную кубическую решетку, Ве, Mg - гексагональную плотно-упакованную структуру, Ва -объёмноцентрированную кубическую решетку, Са, Sr - гранецентрированную. Внешние электроны могут при возбуждении переходить на более высокие энергетические уровни. При обратном переходе на низкий уровень выделяется энергия в виде электромагнитных колебаний. Для этих металлов энергии переходов невелики, так что длина волны излучения соответствует видимой части спектра. Поэтому рассматриваемые элементы окрашивают пламя в:
Li — красный Ве - не окрашивает
Na—желтый Мg- ослепительно белый
К-лиловый Са- кирпич но-красный
Rb- красный Sr - малиновый
Сs - голубой Ва - яблочно-зеленый цвета.
Элементы имеют постоянную степень окисления +1 для группы IА и +2 для группы IIА. С увеличением порядкового номера, размеры атомов увеличиваются, энергия ионизации уменьшается. Металлы являются восстановителями:
Ме - пе =Меn+
2. Нахождение в природе
Металлы находятся в природе только в виде соединений. Наиболее распространены Na,K,Ca,Mg.
Основные природные соединения:
| LiАl[Si206] сподумент |
| NaС1 каменная соль |
| Na[А1308] натриевый полевой шпат(альбит) |
| Nа2 SO4 • 10Н2Омирабилит(глауберова соль) |
| КСl сильвин |
| NаС1 • КС1сильвинит |
| КС1 • МgС12 • 6Н20 карналит |
| КС1 • MgS04 • ЗН20 каинит |
| 3ВеО А1203 • 6SIO2=Ве3А12 [Si6018]берилли |
| А12Ве04 хризоберилли |
| Ве 2[SiO4] фенакит |
| MgS04 • н2о кизерит |
| СаСОз- MgCOз доломит |
| MgCOз магнезит |
| 3MgO • 2SiO2- 2Н20 азбест |
| СаСОз кальцит, аргомит,мрамор,мел |
| СаS04 • 2Н20 гипис |
| СаS04 ангидрит |
| Са3(Р04)2 - СаF2 • СаС12 апатит |
| CrСО3 стронцианит |
| CrSO4 целестин |
| ВаS04 барит(тяжелый шлаг) |
| ВаСОз витерит |
13.Неметаллы и ихсоединения.При нормальных условиях водород, азот, кислород, фтор, хлор и благородные газы находятся в газообразном состоянии, бром — в жидком, а остальные — в твердом состоянии. Из газообразных только кислород имеет аллотропные модификации: кислород 02 и озон Оз. В твердом же состоянии неметаллов это явление распространено широко. Например, бор имеет а-, ^-ромбоэдрические и тетрагональную модификации аллотропные формы углерода: алмаз, графит, карбин, фуллерены; кремний, фосфор, сера и другие неметаллы широко представлены своими аллотропными модификациями, порой резко отличающимися по своим физическим свойствам. Из всего сказанного следует, что физические свойства неметаллов являются в значительной мере их индивидуальными свойствами, поэтому они рассматриваются в разделах по свойствам отдельных групп элементов.
Химические свойства неметаллов нередко сильно отличаются друг от друга, однако в их проявлениях есть и много общего. Большинство неметаллов, за исключением фтора и благородных газов, проявляют как отрицательные, так и положительные степени окисления. Поэтому они могут в химических реакциях быть и окислителями, и восстановителями, за исключением фтора (только окислитель) и благородных газов (Кr, Хе, Rn — только восстановители, остальные — инертны). Сверху вниз по подгруппе устойчивость положительных степеней окисления увеличивается, что можно объяснить увеличением радиусов атомов, увеличением значения главного квантового числа внешних электронов атомов, а следовательно, уменьшением энергии ионизации. По тем же причинам, из-за уменьшения сродства к электрону, устойчивость отрицательной степени окисления в данном направлении уменьшается.
Закон эквивалентов.
Эквивалентом в-ва наз-ся такое его кол-во,¡ взаимодействует с 1 молем атомов водорода или вытесняет такое же кол-во атомов водорода в хим-их р-ях.
HCl ЭCl=1; H2O Э0=1/2; NH3 Э n=1/3
Масса 1 эк-та наз-ся эк-ной массой (Э)
 , В-валентность
, В-валентность
NO  г/моль
г/моль
Закон эквивалентов: в-ва реагируют м/у собой в эквив-ых кол-вах.
Вычисление эквив-ов простых и сложных в-в.
Эквивалентом в-ва наз-ся такое его кол-во,¡ взаимодействует с 1 молем атомов водорода или вытесняет такое же кол-во атомов водорода в хим-их р-ях.
Эквив-ая масса в-ва = сумме эквив-ов, состав-щих данное в-во элементов.

 , где
, где
В - валентность элемента
r-число атомов элемента


Основность кислоты опр-ся кол-вом атомов водорода, вступивших в реакцию.
H2SO4+2NaOH ÞNa2SO4+2H2O
ЭH2SO4=98/2=49г/моль
 Кислотность осн-ия опр-ся кол-вом гидроксильных групп, всткпивших в реакцию
Кислотность осн-ия опр-ся кол-вом гидроксильных групп, всткпивших в реакцию
Al(OH)3+3HClÞAlCl3+3H2O

Al(OH)3+HClÞAl(OH)2Cl+H2O


(знаменатель-фактор эквивалентности (f))

Моль
моль–кол-во в-ва,содержащее столько структурных единиц (атомов, молекул, ионов),ск-ко атомов содержится в 0,012кг изотопа углерода 126С.Масса 1 моля данного в-ва- это его молярная масса, g измеряется в г/моль или кг/моль. Молярная масса = отношению массы в-ва к кол-ву в-ва(М=m/n).Молярная масса серной кис-ты МН2SO4=98г/моль.
Закон Авогадро<
