Принимает цифровые и буквенные значения: 1, 2, 3, 4, 5, 6, 7; или K, L, M, N, O, P, Q .
Максимальное число электронов находят по формуле 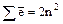 .
.
Примеры :
1) 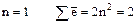 (т.е. на первом слое находится число
(т.е. на первом слое находится число 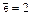 );
);
2) 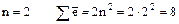 (на втором слое может быть
(на втором слое может быть 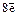 );
);
3) 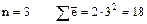 (на третьем слое -
(на третьем слое - 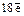 ).
).
Орбитальное (азимутальное) квантовое число l. Характеризует форму электронного облака. Принимает цифровые и буквенные значения (см. табл. 2).
Таблица 2
Цифровые и буквенные значения орбитального квантового числа
| l | n | |||
| Цифровые значения | 0, 1 | 0, 1, 2 | 0, 1, 2, 3 | |
| Буквенные значения | s | s, p | s, p, d | s, p, d, f |
| Форма орбитали | «сфера» | «гантель» | «четырёх-лепестковая» | «шести-лепестковая» |
Буквенные значения орбитального числа совпадают с названием энергетического подуровня.
Цифровые значения находят по формуле: lmax = n – 1. Анализ табл.2 показывает, что на каждом новом электронном слое имеются орбитали уже известной формы и появляются новые орбитали. Размер атомных орбиталей разной формы возрастает с увеличением n.
Магнитное квантовое число m. Указывает на ориентацию облаков в пространстве. Для каждого конкретного l принимает ряд целых значений.
m: -l, …-2, -1, 0, +1, +2, …+l, т.е. всего (2l + 1) значений – это число говорит о количестве одинаковых орбиталей в подуровне. Из этого следует, что m = 2l + 1.
Примеры:
1) n = 1, l = 0 (s-облако) – сколько их на каждом слое?
m = 2×0 + 1 = 1 – т.е. s-орбиталь всегда одна.
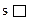 .
.
2) n = 2, l = 0, 1
s-орб. р-орбитали – сколько их?
m = 2×1 + 1 = 3 – т.е. р-орбиталей три.
 .
.
3) n = 3, l = 0, 1, 2;
1 s-орб. 3 р-орб. d-орбитали – сколько их?
m = 2×2 + 1 = 5.
 .
.
4) n = 4, l = 0, 1, 2, 3

1 s-орб. 3 р-орб. 5d-орб. f-орбитали – сколько их?
m = 2l + 1 = 2×3 + 1 = 7.
 .
.
Спиновое квантовое число s. Характеризует собственное вращение электрона, которое имеет место наряду с его вращением по орбитали.”spin” – англ. «веретено, вращение». Величина векторная, принимает значения: 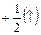 ;
;
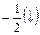 .
.
Т.к. на каждой орбитали может находиться не более 2-х электронов, отличающихся спинами, то максимальное число электронов на энергетическом подуровне находят по формуле: 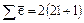 .
.
Принцип (запрет) Паули: в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел;
следствие – на одной орбитали может находиться не более двух электронов.
Правило Гундаучитывают при составлении электронно-графических формул:
1)При заполнении подуровня с несколькими одинаковыми орбиталями эти орбитали вначале заполняются по одному электрону, а когда не останется свободных – по второму электрону.
2)При заполнении орбиталей по одному электрону их спиновые числа должны быть одинаковы.
а)
| ¯ | |
суммарное спиновое число = 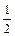 ,
,
б)
| |  | |
суммарное спиновое число = 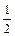 ,
,
в) правильные схемы:
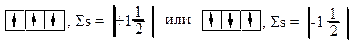
При составлении электронных формул следует помнить, что d-орбитали заполняются электронами с отставанием на один период, а f-орбитали – с отставанием на два периода:
- в 1 периоде2 элемента, т.к. на первом электронном слое имеются только 2 электрона (s);
- во 11 периоде8 элементов, что соответствует восьми электронам на втором электронном слое (s,p);
- в 111 периоде 8 элементов, хотя должно бы быть 18, т.к. на третьем слое может быть восемнадцать электронов (s, p, d). То есть d-орбитали на третьем слое не заполняются. Почему? Это отставание объясняется принципом минимальной энергии илиправилом Клечковского:электроны заполняют подуровни в порядке постепенного увеличения суммы главного и орбитального квантовых чисел (n + l); если для нескольких подуровней эти суммы принимают одинаковые значения, то вначале заполняются подуровни с меньшим значением числа n. Рассмотрим порядок заполнения орбиталей по всей Периодической таблице и сопоставим это со значениями сумм (n+l); для l берем цифровые значения ( у орбиталей s–формы l = 0; у p-орбиталей l = 1; у d–орбиталей l = 2; у f–орбиталей l = 3 ):
| Порядок заполнения | 1s | 2s | 2р | 3s | 3p | 4s | 3d | 4р | 5s | 4d | 5p | 6s | 4f |
| å (n + l) |
Валентные электроны – такие, которые могут принимать участие в образовании химической связи.
Все элементы Периодической системы можно разделить на 4 группы (семейства):
s-элементы: их валентные электроны находятся на s-орбиталях внешнего слоя; это первые два элемента каждого периода (например, 3Li: 1s22s1)
p-элементы:их валентные электроны находятся на s- и p-орбиталях внешнего слоя; это последние шесть элементов каждого периода (например,
9F: 1s22s22p5)
d-элементы: их валентные электроны находятся на s–орбиталях внешнего слоя и d–орбиталях предпоследнего слоя; это вставные десять элементов
больших периодов (например, 25Mn: 1s22s22p63s23p64s23d5)
f-элементы:их валентные электроны находятся на s-орбиталях внешнего слоя, d-орбиталях предпоследнего слоя и f-орбиталях третьего снаружи слоя (лантаноиды и актиноиды, например 59Pr: 1s 2 2s 2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f2).
