Сложные эфиры карбоновых кислот
Сложными эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов (остатков спирта) и кислотных остатков, соединенных атомом кислорода. Сложные эфиры можно рассматри-
вать как продукт взаимодействия спиртов и карбоновых кислот.
Этилацетат. Физические и химические свойства. Этилацетат — жидкость с приятным ароматным запахом, легко испаряется, плохо растворяется в воде. С воздухом этилацетат образует взрывчатые смеси. Концентрационные пределы воспламенения: НПВ — 3,55%, ВПВ —
16,8% (вычисленные). Эфир способен к электризации. Этилацетат самовозгорается в контакте с хромовым ангидридом СгОз, с перекисью натрия Nа202 в присутствии воды, с перманганатом калия КМпО4, хлоратом калия КС103 в присутствии серной кислоты. На воздухе горит светящимся пламенем с выделением значительного количества тепла.
Важнейшим химическим свойством, сложных эфиров является разложение их водой на кислоту и спирт. Эта реакция сложного эфира с водой называется гидролизом или омылением. Если этилацетат нагревать с водой в присутствии минеральной кислоты или щелочи, то образуются уксусная кислота и этиловый спирт
О
II
Сн3— с— о-с2н5 + н2о —> сн3соон + С2Н5он
Получение и применение. Этилацетат получают при нагревании смеси этилового спирта с уксусной кислотой в присутствии концентрированной серной кислоты (реакция этерификации)
О
СН3—СООН + С2Н5ОН 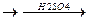 СН3—С—О-С2Н5 + Н2О
СН3—С—О-С2Н5 + Н2О
нагревание
Эфиры уксусной кислоты хранят в стеклянных сосудах емкостью 15 — 20 кг, установленных в корзины с древесной стружкой, а также в бочках, цистернах.
Жиры (глицериды) представляют собой сложные эфиры трехатомного спирта (глицерина) и карбоновых кислот. Жиры бывают животного и растительного происхождения. Растительные жиры называются маслами. Большая часть глицеридов в природных жирах представляет собой эфиры; трипальмитинат (С15Н31СОО)3С3Н5—
глицерид пальмитиновой кислоты, тристеарат (С17Н35СОО)3С3Н5 — глицерид стеариновой кислоты, триолеинат (С17НззСОО)зС3Н5 — глицерид олеиновой кислоты и т. д. Жиры имеют важное значение как пита-
тельные вещества, кроме того, они имеют большое техническое значение.
Физические и химические свойства.Все жиры легче воды (их плотность 900 — 950 кг/м3) и нерастворимы в ней. Жиры растворяются во многих органических растворителях (бензине, эфире, сероуглероде, четыреххлористом углероде и др.). Все жиры являются горючими веществами. При горении их выделяется большое количество тепла: 1 г жира при горении дает 39060 кДж.
Масла и некоторые животные жиры склонны к самовозгоранию при определенных условиях. Для оценки способности масел к самовозгоранию необходимо знать количество ненасыщенных связей, что оценивают иодным
числом.
При нагревании с водой жиры разлагаются на глицерин и соответствующие кислоты. Жидкие жиры (масла) на воздухе способны окисляться, превращаясь при этом в твердые вещества.
Нитросоединения
Нитросоединениями называют органические вещества,
молекулы которых содержат одну или несколько групп —NO2, причем атом азота непосредственно связан с атомом углерода. Нитросоединения получают реакцией нитрования углеводородов.
Нитробензол. Физические и химические свойства.
Нитробензол имеет структурную формулу
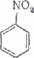
Он представляет собой желтоватую жидкость плотностью 1200 кг/м3, имеет запах горького миндаля, в воде не растворяется, хорошо растворяется в серной кислоте с выделением тепла, ядовит. Температура кипения нитробензола 210,9°С, температура плавления 5,7°С, температура вспышки 90°С, температура самовоспламенения 495°С.
Нитробензол не обладает взрывчатым свойством; при поджигании горит, выделяя большое количество тепла. При действии на него атомного водорода, например, выделяющегося в реакционной среде, нитробензол восстанавливается до анилина
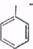 N02
N02
+ 6Н 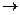
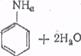
 Для проведения этой реакции нитробензол добавляют к соляной кислоте и вносят железные стружки. При взаимодействии железа с кислотой выделяется атомный водород, который и восстанавливает нитробензол.
Для проведения этой реакции нитробензол добавляют к соляной кислоте и вносят железные стружки. При взаимодействии железа с кислотой выделяется атомный водород, который и восстанавливает нитробензол.
Получение и применение. Нитробензол получают из бензола, действуя на него смесью азотной и серной кислот.
Реакция протекает с выделением значительного количества тепла, поэтому реакционный сосуд постоянно охлаждают. В промышленности реакцию нитрования проводят в специальных аппаратах — нитраторах.
В значительных количествах нитробензол применяют для получения анилина, который является исходным сырьем для производства красителей. Нитробензол применяют также для получения авиационных масел и взрывчатого вещества динитробензола.
Тринитротолуол.Физические и химические свойства.
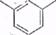
Тринитротолуол имеет структурную формулу
СН3
О2N | NO2
|
NO2
Тринитротолуол (тротил, или тол) представляет собой твердое кристаллическое вещество желтого цвета, плотностью 1,66 г/см3, с температурой плавления 81 °С, температурой самовоспламенения 290—295°С. В холодной воде тринитротолуол не растворяется, хорошо растворяется в спирте, бензоле, толуоле, ацетоне и др. Тринитротолуол является сильным взрывчатым веществом.
При длительном нагревании тринитротолуол окисляется азотной кислотой; с металлами не взаимодействует, но со щелочами образует взрывчатые соединения, более реакционноспособные, чем сам тринитротолуол. Химическая стойкость его высокая, даже при длительном нагревании при температурах до 130°С. Заметное разложение происходит лишь при температурах выше 153°С.
При поджигании на воздухе тринитротолуол горит сильно коптящим пламенем, в определенных условиях горение тринитротолуола может перейти в детонацию (взрыв).
Получение и применение. Тринитротолуол получают нитрованием толуола С6Н5СН3. Эту реакцию проводят в три стадии, при которых в молекулу толуола вводят последовательно сначала первую, затем вторую и третью нитрогруппы.
Сочетание таких свойств, как большая стойкость, малая чувствительность к внешним воздействиям, отсутствие взаимодействия с металлами, нерастворимость в воде, достаточная мощность взрыва (т. е. образование большого количества газообразных веществ при разложении),
сделало тринитротолуол основным бризантным взрывчатым веществом. Тротил широко применяют для наполнения артиллерийских снарядов, мин, торпед, авиабомб, ручных и противотанковых гранат. Температура взрыва тринитротолуола составляет 2800 °С. Для снаряжения боеприпасов тротил применяют как самостоятельно, так и в виде сплавов и смесей с другими взрывчатыми веществами. Наиболее широко в военное время применяют смеси аммонийной селитры с толом — аммотолы, содержащие от 10 до 60 % тола. Для строительных и горнорудных подрывных работ тротил применяют в виде шашек (толовые шашки).
Продуктами неполного нитрования толуола являются мононитротрлуол и динитротолуол. Мононитротолуол — жидкость красно-коричневого цвета, нерастворимая в воде, хорошо растворимая в горячих щелочах и большинстве органических растворителей, хорошо растворяет ди- и тринитротолуол.
Динитротолуол — твердое вещество желтоватого цвета с температурой плавления около 70 °С, плохо растворяется в воде и тяжелее ее, очень хорошо растворяется в мононитротолуоле и других органических растворителях. Его можно применять как составную часть различных взрывчатых веществ. Самостоятельно как взрывчатое вещество динитротолуол не используют.
