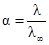Степень ионизации слабых электролитов
Поскольку в растворах слабых электролитов происходит ионизация растворенного вещества, долю распавшихся на ионы молекул электролита предпочтительнее называть степенью ионизации, а не степенью электролитической диссоциации. Рассмотрим факторы, влияющие на степень ионизации слабого электролита.
1. Природа электролита. Различные электролиты при одинаковых концентрациях и температурах могут весьма существенно отличаться по степени ионизации. Например, для одноосновных кислот СН3СООН, HClO и HCN в 0,1 М растворах при 25 ˚С степень ионизации составляет 1,32; 0,054 и 0,007% соответственно.
2. Концентрация раствора.
С разбавлением (уменьшением концентрации) раствора степень ионизации слабого электролита увеличивается (закон разбавления В. Оствальда). Действительно, разбавление раствора сопровождается понижением его осмотического давления, что приводит к смещению равновесия в сторону процесса ионизации, поскольку этот процесс сопровождается увеличением числа частиц и, следовательно, осмотического давления. Так, для уксусной кислоты понижение концентрации от 0,1 до 0,0001 моль/л сопровождается повышением степени ионизации от 1,32% до 42%.
3. Температура. Повышение температуры обычно сопровождается увеличением степени ионизации. Однако известны вещества, для которых при повышении температуры степень ионизации проходит через максимум.
Степень ионизации может быть определена разными методами. Чаще всего ее устанавливают путем измерения изотонического коэффициента или электропроводности раствора.
Как указывалось выше, изотонический коэффициент раствора равен отношению экспериментально установленного значения коллигативного свойства к величине, рассчитанной по уравнениям Вант-Гоффа и Рауля:
i = 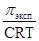 или i =
или i = 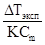 ,
,
где p - осмотическое давление, ΔТ - повышение температуры кипения или понижение температуры замерзания раствора.
Пусть в данном объеме раствора растворено N молекул вещества, степень ионизации которого равна α, тогда число распавшихся на ионы молекул будет равно αN, а число неионизированных молекул электролита равно N(1-α). Если из каждой распавшейся молекулы электролита образуется n ионов, то число образовавшихся ионов – nαN.
i = 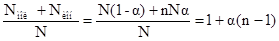 , откуда
, откуда 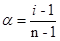
Таким образом, измерив понижение температуры замерзания, повышение температуры кипения или осмотическое давление раствора, можно рассчитать степень ионизации электролита, зная его концентрацию.
Второй способ определения степени ионизации основан на измерении электропроводности раствора электролита. Электропроводность раствора - это величина, обратная его электрическому сопротивлению. Различают удельную и эквивалентную электропроводность растворов. Удельная электропроводность (k) - это электропроводность 1 см3 раствора, заключенного между параллельными электродами площадью 1 см2; размерность удельной электропроводности - Ом-1·см-1. При разбавлении раствора удельная электропроводность понижается. Эквивалентная электропроводность (λ) - это электропроводность раствора, содержащего 1 моль эквивалента растворенного вещества, заключенного между параллельными электродами, отстоящими друг от друга на 1 см. Размерность эквивалентной электропроводности - см2·Ом-1·моль-1. Удельная и эквивалентная электропроводности связаны соотношением:
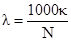 ,
,
где N - нормальность раствора. При разбавлении раствора эквивалентная электропроводность повышается, стремясь к некоторой постоянной для данного электролита величине, называемой эквивалентной электропроводностью при бесконечном разбавлении (λ∞) и отвечающей полной ионизации содержащегося в растворе электролита, т.е. ситуации, когда степень ионизации равна единице. Cтепень ионизации прямо пропорциональна эквивалентной электропроводности и может быть рассчитана по уравнению: