Теория электролитической диссоциации (ионизации)
В начале XIX столетия, после изобретения А. Вольтом первого химического источника электрического тока, было обнаружено, что водные растворы ряда химических соединений (кислот, щелочей, солей) способны проводить электрический ток. Первоначально предполагалось, что это явление обусловлено тем, что кислоты, основания и соли под действием электрического тока распадаются на ионы - положительно и отрицательно заряженные частицы, способные направленно перемещаться в электрическом поле. Вещества, растворы которых проводят электрический ток, были названы электролитами (в переводе с греческого - "расщепляемые электричеством").
После открытия законов Рауля и Вант-Гоффа было обнаружено, что эти законы не применимы к растворам электролитов. Водные растворы кислот, щелочей и солей кипят при более высоких, а замерзают при более низких температурах, чем это следует из закона Рауля. Их осмотическое давление превышает величину, рассчитанную по уравнению Вант-Гоффа. Растворы электролитов, таким образом, ведут себя так, как будто действительное число частиц в этих растворах больше, чем в растворах неэлектролитов той же молярности. Стремясь распространить уравнения, описывающие коллигативные свойства растворов неэлектролитов, на растворы электролитов, Вант-Гофф предложил ввести в соответствующие уравнения поправочный множитель i, названный изотоническим коэффициентом.
p= iCRT; ΔТкип = iECm; ΔТзам = iKCm
В полученных уравнениях коэффициент i в случае неэлектролитов равен единице, а в случае электролитов превышает единицу. Было установлено, что значение i зависит от природы электролита и концентрации раствора. При разбавлении раствора изотонический коэффициент возрастает, стремясь к целым числам (например, к двум для хлорида натрия, к трем для хлорида кальция и т.д.).
В 1887 г. С. Аррениус показал, что особенности растворов электролитов могут быть объяснены, если предположить, что электролиты распадаются на ионы не под действием электрического тока, а непосредственно в процессе растворения. С. Аррениусом была разработана теория электролитической диссоциации, сводящаяся к следующим основным положениям:
1. Электролиты в растворе самопроизвольно распадаются на ионы. Процесс распада электролита на ионы под действием растворителя называется электролитической диссоциацией (ионизацией). Растворители, вызывающие ионизацию растворенного вещества, называются ионизирующими. Кроме воды, ионизирующими растворителями являются жидкий фтороводород, жидкий аммиак, в меньшей мере метанол, этанол, муравьиная кислота и другие вещества. Поскольку при диссоциации молекула электролита образует не менее двух ионов, число частиц при диссоциации увеличивается, что и приводит к отклонению свойств раствора от законов Вант-Гоффа и Рауля.
2. Изотонический коэффициент Вант-Гоффа представляет собой отношение действительного числа частиц в растворе (N΄) к их числу без учета процесса диссоциации (N):
i = 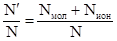
3. Процесс электролитической диссоциации обратим: наряду с диссоциацией в системе протекает ассоциация - образование молекул растворенного вещества из ионов. Поэтому в растворе электролита XY устанавливается равновесие:
XY  X+ + Y-,
X+ + Y-,
которое может быть смещено в сторону как прямой, так и обратной реакции в соответствии с принципом Ле-Шателье. Этим объясняется, в частности, изменение коэффициента i при разбавлении раствора.
Количественно процесс диссоциации характеризует степень электролитической диссоциации (ионизации). Степень электролитической диссоциации (α) - это отношение числа молекул электролита, распавшихся на ионы (Nрасп), к первоначальному числу молекул растворенного вещества (N):
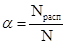
Таким образом, степень электролитической диссоциации равна доле молекул электролита, распавшихся на ионы, и, соответственно, изменяется от нуля до единицы (или от 0 до 100%).
В зависимости от наблюдаемого значения степени электролитической диссоциации в растворах, содержащих 0,1 моль-экв./л растворенного вещества, электролиты подразделяются на три группы:
1. Сильные электролиты (α > 30%). К сильным электролитам в водных растворах относятся многие неорганические кислоты (например, HCl, HNO3, H2SO4), гидроксиды щелочных и щелочноземельных металлов и почти все соли.
2. Слабые электролиты (α < 3%). Слабыми электролитами являются большинство органических кислот (например, уксусная), некоторые неорганические кислоты (например, HF, H2SO3), аммиак и амины, а также некоторые соли (HgCl2, HgBr2).
3. Электролиты средней силы (3 < α < 30%). Примерами таких электролитов могут служить фосфорная (Н3РО4), щавелевая (Н2С2О4) и хлоруксусная (ClСН2СООН) кислоты.
Теория электролитической диссоциации объяснила причины неподчинения растворов электролитов законам Рауля и Вант-Гоффа. Однако эта теория в изложенной выше форме не учитывала влияние на процесс диссоциации ряда факторов, а потому оказалась применимой не для всех групп электролитов. Чтобы определить границы приложения этой теории, рассмотрим современные представления о механизме ионизации электролитов в растворах.
Распаду на ионы могут подвергаться вещества как с ионной, так и с полярной ковалентной связью. Если вещество имеет ионную кристаллическую решетку, то процесс образования раствора электролита сводится к разъединению ионов кристалла и распределению их по всему объему раствора. Этот процесс связан с химическим взаимодействием ионов поверхностного слоя кристалла с молекулами растворителя, например, воды. В результате в раствор переходят не свободные, а сольватированные ионы, свойства которых существенно отличаются от свойств соответствующих ионов в кристалле или в газовой фазе. Поскольку ионы в данном случае не образуются, а лишь разъединяются, этот процесс уместно называть электролитической диссоциацией.
Для веществ, образованных полярными молекулами, наблюдается иной механизм распада на ионы. В этом случае между молекулами растворенного вещества и полярными молекулами ионизирующего растворителя реализуется межмолекулярное диполь-дипольное взаимодействие. При этом молекулы растворителя ориентируются так, как это показано на рис. 25. В результате полярность связи в молекулах электролита возрастает вплоть до её разрыва и образования сольватированных ионов. Этот процесс уместно назвать процессом ионизации, так как он сопровождается образованием ионов, отсутствующих изначально в растворяемом веществе. Таким образом, в растворе хлорида натрия будет протекать процесс электролитической диссоциации, а в растворе хлороводорода - процесс ионизации.
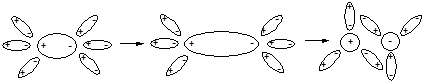
Рис. 25. Ионизация полярной молекулы.
Вторым фактором, который теория Аррениуса не учитывает, является электростатическое взаимодействие ионов, в то время как отталкивание одноименно заряженных ионов и притяжение ионов с противоположным знаком заряда существенно влияет на свойства растворов электролитов, причем тем сильнее, чем больше концентрация ионов в растворе. В результате теории Аррениуса наиболее строго следуют только слабые электролиты, в растворах которых содержатся как молекулы, так и ионы электролита, а электростатическое взаимодействие между ионами невелико, так как их концентрация мала.
