Опыт № 1 Изменение рН в ходе окислительно – восстановительной реакции.
1. В два стакана на 50 мл наливают реагенты одной реакции (см. табл. 1) на 4 см по высоте.
2. рН – электрод погружают в раствор первого реагента не менее, чем на 3 см. После стабилизации показаний прибора, записывают значение рН в таблицу 1.
3. Ополаскивают рН – электрод дистиллированной водой и погружают в раствор второго реагента. Записывают значение рН в табл. 1.
4. Смешивают реагенты. Ополаскивают рН – электрод и измеряют рН продуктов реакции. Записывают значение рН и наблюдения.
5. Процедуру повторяют с остальными парами реагентов.
Таблица 1
| Реагент | рН1 | Реагент | рН2 | рН после смешивания реагентов | Наблюдения |
| KMnO4 | MnCl2 | ||||
| I2 | Na2SO3 | ||||
| KI | FeCl3 |
6. Записывают уравнения реакций, используя ионно – электронный метод. Сравнивают экспериментальные и теоретические результаты.
Опыт № 2. Зависимость характера продуктов ОВР от рН среды.
Таблица 2
| № пробирки | Порядок смешивания реагентов | Наблюдения |
| 3 капли раствора KMnO4+3 капли раствора H2SO4+4 капли раствора Na2SO3 | ||
| 3 капли раствора KMnO4+4 капли раствора Na2SO3 | ||
| 4 капли раствора КОН+4 капли раствора Na2SO3+3капли раствора KMnO4 |
1. Смешивают реагенты в порядке, указанном в табл. 2. При отсутствии видимых изменений в пробирках 1 и 2 объём раствора Na2SO3 увеличивают.
2. В каждом случае отмечают характер изменений в пробирках.
3. Записывают уравнения реакций, используя ионно – электронный метод. Делают вывод о влиянии рН на ОВР.
Опыт № 3. Определение направления окислительно-востановительной реакции.
1. Пользуясь значениями стандартных окислительно – восстановительных потенциалов (φ0), приведённых в табл. 3, прогнозируют возможность протекания процессов.
Таблица 3
| № пробирки | Уравнение ОВР | φ0 окислит. – восст. пар | Направление ОВР |
| 2Fe3++2I-↔2Fe2++I2 | φ0 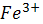 /Fe2+=0,77B φ0I2 /2I- =0,54B /Fe2+=0,77B φ0I2 /2I- =0,54B | ||
| 2Fe3++2Br-↔2Fe2++Br2 | φ0 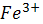 /Fe2+=0,77B φ0Br2 /2Br- =1,09B /Fe2+=0,77B φ0Br2 /2Br- =1,09B |
2. Правильность выводов проверяют экспериментально. Для этого в первой пробирке смешивают 2 мл раствора FeCl3 и 1 мл раствора KI, в другой – 2 мл раствора FeCl3 и 1 мл раствора KBr.
3. В лабораторном журнале отмечают изменения, происшедшие в пробирках. Делают выводы о соответствии теоретических и экспериментальных данных.
Вопросы к защите работы
1. Напишите уравнения для расчёта окислительно – восстановительного потенциала реакций
Fe3++1e→ Fe2+
I2+2e→2I-
Br2+2e→2Br-
От каких факторов зависит окислительно – восстановительный потенциал?
2. Напишите уравнение для расчёта окислительно – восстановительного потенциала реакции
N 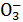 +3Н+ +2е↔HNO2 +H2O
+3Н+ +2е↔HNO2 +H2O
Рассчитайте его значения при активности ионов Н+ (моль/л) 10-2 и 10-10.
Данные для расчёта: φ0 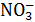 /HNO2=0, 94В, а(
/HNO2=0, 94В, а(  =а(
=а( 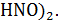 T=298K.
T=298K.
3. К подкисленному раствору KI добавляют несколько капель раствора NaNO2 и крахмала. Раствор приобретает тёмно – синий цвет. Функция (окислителя или восстановителя) NaNO2 в данном опыте?
4. К подкисленному раствору I2 добавляют до обесцвечивания раствор NaNO2. Функция NaNO2 в данном опыте?
5. По отношению к воде некоторые вещества ведут себя как окислители, другие – как восстановители. Приведите примеры таких веществ и напишите уравнения ОВР.
Задания для контроля уровня сформированности компетенций в учебное время.
При отравлении сероводородом пострадавшему дают подышать слегка увлажнённой хлорной известью. Докажите возможность данного метода детоксикации, использую константу оксислительно-восстановительного процесса.
