IV. Реакции галогенопроизводных углеводородов с металлами
При низких температурах металлы I группы периодической таблицы с галогенопроизводными углеводородов образуют металлоорганические соединения (вещества, содержащие связь между атомами металлов и углерода).
СH3CH2CH2CH2Cl + 2 Li ¾® СH3CH2CH2CH2 Li + LiCl
бутиллитий
Вюрца реакция - синтез высших алканов реакцией низших галоген-алканов с натрием.Реакция Вюрца для одного R-Cl дает симметричный углеводород строения R-R:

СH2=CH–CH2–Cl + 2 Na + Сl–СH2–CH=CH2 ¾® СH2=CH–CH2–СH2–CH=CH2
гексадиен-1,5
Дициклопентил можно синтезировать по схеме:
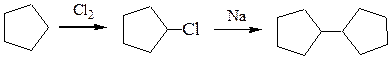
дициклопентил
Если для реакции Вюрца взять два различных галогеналкана, то образуется смесь из трех углеводородов:
Контрольные вопросы к главе 6 «Галогенопроизводные углеводородов»
№ 1.Какие известны методы синтеза галогенопроизводных углеводородов? Охарактеризуйте полярность и поляризуемость связей С–H, C–F, C–Cl, C–Br, C–I. Почему йодалкилы обладают наибольшей реакционной способностью?
№ 2.Напишите общую схему реакции нуклеофильного замещения. Какими особенностями строения обладают нуклеофилы? На примере щелочного гидролиза 4-хлор-1-метилциклогексана разберите сущность механизмов SN1 и SN2. Укажите условия, способствующие протеканию реакции по каждому механизму. Для SN1 и SN2. сравните: кинетику, стереохимию, зависимость скорости реакции от природы радикала, галогена, нуклеофила и растворителя.
№ 3.Приведите примеры и объясните,какие типы галогенопроизводных углеводородов обладают нормальной, пониженной или повышенной склонностью к реакциям нуклеофильного замещения. В каком порядке изменяется подвижность брома в следующих соединениях: 5-бром-2-метилпентан; 3-бром-2-метилпентен-2; 4-бром-2-метилбутен-2?
№ 4.Какие вещества образуются при гидролизе:(а) 1,1-дибромгексана; (б) 2,2-дихлороктана; (в) 2-хлор-3-бромпентана; (г) п-хлорбензотрихлорида (без нагревания); (д) бромистого кротила CH2-CH=CH-CH2-Br (в условиях, благоприятствующих механизму SN1); (е) 3-бром-1-метилциклопентана.
№ 5.Напишите уравнения реакций: (а) хлористого бензила с нитритом серебра; (б) бромистого изопентила с цианидом калия; (в) изопропилхлорида с гидросульфидом калия; (г) хлористого октила с иодидом натрия (в ацетоне); (д) бутилбромида с сульфидом натрия; (е) 1-бромгексана с фенолятом натрия (ж) 3,4-дибромгексана с цинковой пылью; (з) п-бромтолуола с натрием.
№ 6.Расшифруйте цепочки последовательных химических реакций:
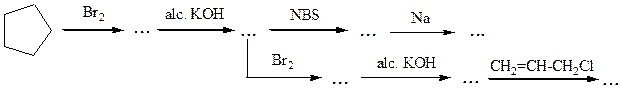
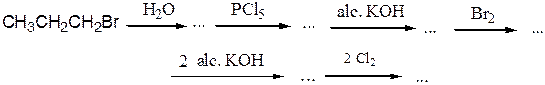
№ 7.Из ацетилена получите: (а) 2,3-дибромбутан; (б) 1,2-дибромбутен-2;(в) 1,4-дибромбутен-2; (г) 1,1,2,2,3,4-гексахлорбутан.
МАГНИЙОРГАНИЧЕСКИЙ СИНТЕЗ
Получение магнийорганических соединений.Смешанные магний-органические соединения(реактивы Гриньяра) обычнополучают реакцией галогенопроизводных углеводородов со стружками металлического магния в среде безводных (абсолютированных) простых эфиров (диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан и др.)
R–X + Mg ¾® R–MgX (где Х = Cl, Br, I)
Магнийорганические соединения можно получить почти из любых алкилгалогенидов (за исключением фторидов), причем скорость взаимо-действия галоидного алкила с магнием в эфире уменьшается от йодида к хлориду. Выходы RMgX уменьшаются при переходе от первичных радикалов к третичным и от хлоридов к иодидам. Основными побочными процессами, осложняющими получение реактивов Гриньяра из галоидных алкилов, являются дегидрогалогенирование и реакция сдваивания радикалов, подобная реакции Вюрца. Первый процесс наиболее характерен для разветвленных алкилгалогенидов, особенно иодидов (например, йодистый третбутил при обработке магнием в эфире в основном превращается в изобутилен); второй протекает тем легче, чем подвижнее галоид в галогенопроизводном (так, для аллилгалогенидов сдваивание радикалов под действием магния в эфире является основным направлением реакции; для получения аллилмагнийгалоге-нида реакцию ведут в разбавленных эфирных растворах и с большим избытком магния) и чем больше радикал. Хлориды ароматического и винильного типов с магнием в эфире не реагируют, однако фенилмагнийхлорид и винил-магнийхлорид (реактив Нормана) могут быть получены, если реакцию вести при кипячении в среде высококипящих простых эфиров (ТГФ, диоксане, дибутиловом эфире). Диброммагнийацетилен (комплекс Йоцича) получают, пропуская ацетилен через этилмагнийбромид:
2C2H5MgBr + НСºСН ¾® BrMg-СºС-MgBr + 2C2H6
(имеет место избыток реактива Гриньяра). Моноброммагнийацетилен может быть синтезирован при добавлении раствора этилмагнийбромида в ТГФ к насыщенному раствору ацетилена в том же растворителе:
C2H5MgBr + HСºCH ¾® HСºC-MgBr + С2Н6
Химические реакции магнийорганических соединений. Основными синтетическими областями применения магнийорганических реагентов являются реакции, в которых они выступают в качестве нуклеофильных соединений.
Для синтеза первичных спиртовиспользуют реакции магнийорганических соединений с формальдегидом и окисью этилена, причем образующиеся продукты содержат в радикале соответственно на один или на два атома углерода больше, чем исходный реактив Гриньяра:
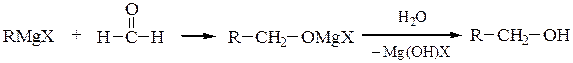
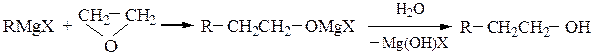
Вторичные спирты получают взаимодействием реактивов Гриньяра с альдегидами, α-окисями монозамещенных этиленов или с производными муравьиной кислоты:
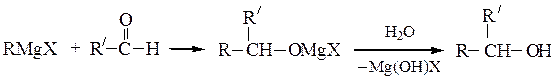
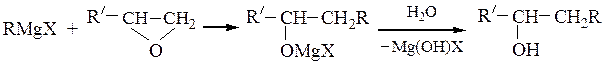
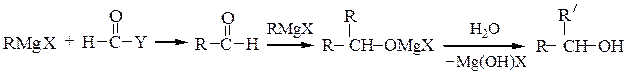
Последнюю реакцию (Y = -OR', галоген) в особых условиях можно остановить на стадии образования карбонильного соединения; конечным продуктом является вторичный спирт, содержащий два одинаковых радикала.
Третичные спирты получают при обработке RMgX кетонами или при двухстадийном превращении производных карбоновых кислот (сложных эфиров, ангидридов, галогенангидридов); в особых условиях можно выделить образующийся при этом кетон:
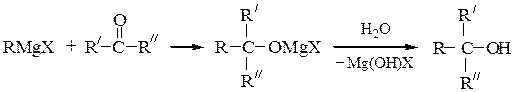
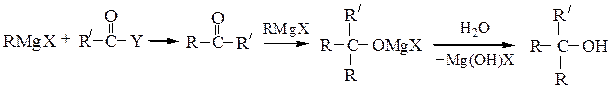
Карбоновые кислоты получают действием оксида углерода (IV) по схеме:
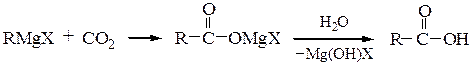
При выполнениив лаборатории этих синтезов следует помнить о том, что магнийорганические соединения очень реакционноспособны и их не рекомендуется долго хранить.
Реактивы Гриньяра вступают в реакции с кислородом и серой:
H2O
R–MgX + ½ O2 ¾® R–OMgX ¾¾® R–OH
спирты
R–MgX + S ¾® R–SMgX ¾¾® R–SH
меркаптаны
Магнийорганические соединения легко разлагаются до углеводородов под действием веществ, содержащих подвижный атом водорода, например:
R–MgX + H–OH ¾® R – H ↑ + Mg(OH)X
вода
R–MgX + H–OR' ¾® R – H ↑ + Mg(OR')X
спирты
R–MgX + H–SH ¾® R – H ↑ + Mg(HS)X
сероводород
R–MgX + H–NH2 ¾® R – H ↑ + Mg(NH2)X
аммиак
R–MgX + H–NH–R' ¾® R – H ↑ + Mg(R'NH)X
первичные амины
R–MgX + H–NR'R'' ¾® R – H ↑ + Mg(R'R''N)X
вторичные амины
R–MgX + H–O–CO–R' ¾® R – H ↑ + Mg(R'COO)X
карбоновая кислота
По той же схеме реактивы Гриньяра будут разлагаться СН-кислотами, например ацетиленом, алкинами-1 и циклопентадиеном:
2 R–MgX + НСºСН ¾® R – H ↑ + ХMg-СºС-MgХ
R–MgX + HСºC–R' ¾® R – H ↑ + R'–СºC-MgBr
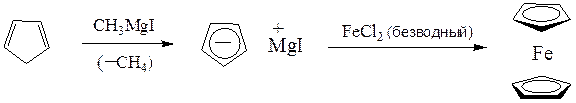
ферроцен
В связи с указанными выше реакциями, разлагающими RMgX до углеводородов, для получения высоких выходов продуктов магний-органического синтеза следует использовать свежеприготовленные реактивы Гриньяра, сухие растворители и реагенты; работы проводить в атмосфере очищенных инертных газов. В случае синтеза вторичных спиртов исходные альдегиды перегоняют для удаления примесей спиртов и карбоновых кислот.
Магнийорганические реагенты удобно использовать при синтезе химических соединений, меченых изотопной меткой (например, D дейтерий – 2H, 14С, 15N, 18О и др.). Вещества, содержащие в молекуле радиоактивные изотопы, не отличаются от обычных аналогов по химическим свойствам, но обнаруживаются при помощи счетчика Гейгера.
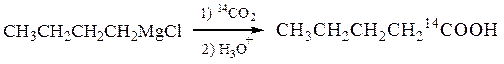
1-14С-пентановая кислота
CH2=CH–CH2–MgBr + D2O ¾¾® CH2=CH–CH2D + Mg(OD)Br
тяжелая вода 3-дейтеропропен-1
Контрольные вопросы к главе 7 «Магнийорганический синтез»
№ 1.Расположите галогенопроизводные в ряд по убыванию активности в реакции с магнием: йодистый метил, хлорбензол, йодбензол; хлористый бутил; бромистый винил, бромистый этил.
№ 2.Наиболее удобным методом синтеза вторичных спиртов является реакция альдегидов с реактивами Гриньяра. Почему для получения высоких выходов используют свежеприготовленные реактивы Гриньяра, очищенные реагенты и безводные растворители в атмосфере чистого инертного газа?
№ 3.Предложите схемы синтеза спиртов, используя химические свойства реактивов Гриньяра: (а) метилдиэтилкарбинола из этанола; (б) метилдиэтил-карбинола из этанола; (в) 3,3-диметилбутанола-1 из изобутилена и этилена; (г) диметилизопропилкарбинола из пропилена.
№ 4.Предложите схему синтеза кислот, используя химические свойства реактивов Гриньяра: (а) циклопентанкарбоновой кислоты из циклопентана; (б) 2-метилбутановой кислоты из бутена-1; (в) п-толуиловой кислоты из толуола; (г) 1-нафтилуксусной кислоты из нафталина.
№ 5.Предложите схемы синтеза соединений, меченых радиоактивными изотопами: (а) изомасляной (1-14С) кислоты (СН3)2СН14СООН из пропилена и Са14СО3; (б) дейтеротолуола С6H5CH2D из толуола и тяжелой воды; (в); 3-дейтеропропилена-1 CH2=CH-CH2D из хлористого аллила и D2O; (г) гексадейтеробензола из ацетилена и тяжелой воды.
№ 6.Реакция пентанона-3 с реактивом Гриньяра и последующим гидролизом приводит к спирту, дегидратация которого дает 2-метил-3-этил-пентен-2. Какова формула реактива Гриньяра?
№ 7.Бромистый алкил образует реактив Гриньяра, который под действием воды превращается в гексан. При обработке натрием получается 4,5-диэтилоктан. Какова структурная формула галогенида?
№ 8. Реакция реактива Гриньяра с диэтилкетоном дает третичный спирт, дегидратация и последующее каталитическое гидрирование которого привели к 3-этилпентану. Каково строение реактива Гриньяра?
СПИРТЫ И ФЕНОЛЫ
Определение.Спирты и фенолы – это производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу (–ОН). У спиртов гидроксильная группа связана с насыщенным углеродным атомом.
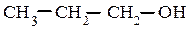
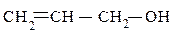
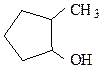
пропиловый спирт аллиловый спирт 2-метилциклопентанол-1
пропанол-1 (IUPAC) пропен-2-ол-1(IUPAC) (IUPAC)
у фенолов – непосредственно с ароматическим кольцом.
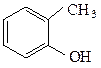
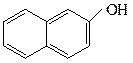
о-крезол β-нафтол
Соединения, содержащие гидроксильную группу, связанную с углеродным атомом боковой цепи арена называют ароматическими спиртами.
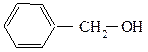
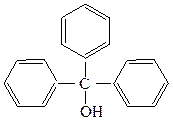
бензиловый спирт трифенилкарбинол
Классификация.
1. По типу углеродного атома, с которым связана ОН-группа, спирты
делят на первичные RCH2OH :
СH3–CH2–CH2–CH2–OH СH3–CH–CH2–OH
│
СH3
бутиловый спирт изобутиловый спирт
бутанол-1 (IUPAC) 2-метилпропанол-1 (IUPAC)
вторичные RR¢CHOH :
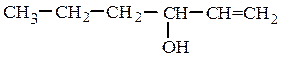
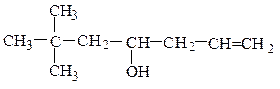
винилпропилкарбинол (рац.) аллилнеопентилкарбинол (рац.)
гексен-1-ол-3 (IUPAC) 6,6-диметилгептен-1-ол-4 (IUPAC)
и третичные RR¢R¢¢COH :
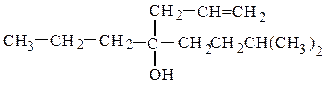
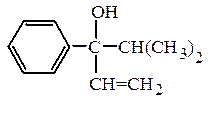
пропилаллилизопентилкарбинол (рац.) винилизопропилфенилкарбинол (рац.)
7-метил-3-пропилоктен-1-ол-4 (IUPAC) 4-метил-3-фенилпентен-1-ол-3 (IUPAC)
Спирты могут быть предельными и непредельными, в зависимости от того, имеется или нет кратная связь в углеводородном радикале, связанном с гидроксильной группой. Непредельные спирты, содержащие одновременно при одном углеродном атоме двойную связь и гидроксил (енолы), очень неустойчивы и сразу же изомеризуются альдегиды или кетоны (правило Эльтекова-Эрленмейера).
2. По числу гидроксильных групп различают одно-, двух- и многоатомные
спирты и фенолы:

метилизопропилкарбинол (рац) β-фенилэтиловый спирт (рац) 3-метилбутанол-2 (IUPAC) 2-фенилэтанол-1 (IUPAC) (одноатомный спирт) (одноатомный спирт)
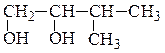
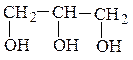
изопропилэтиленгликоль(рац)глицерин
3-метилбутандиол-1,2 (IUPAC) пропантриол-1,2,3 (IUPAC)
(двухатомный спирт) (трехатомный спирт)
Двухатомные фенолы:
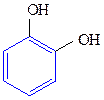
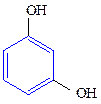
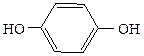
1,2-дигидроксибензол 1,3-дигидроксибензол 1,4-дигидроксибензол
(пирокатехин) (резорцин) (гидрохинон)
Трехатомные фенолы:
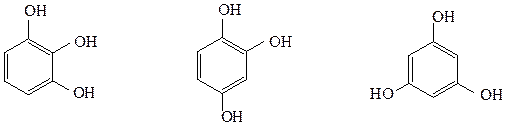
1,2,3-тригидроксибензол 1,2,4-тригидроксибензол 1,3,5-тригидроксибензол
(пирогаллол) (гидроксигидрохинон) (флороглюцин)
Многоатомные спирты устойчивы лишь при условии, что гидроксильные группы связаны с различными атомами углерода. Соединения, содержащие две (или три) гидроксильные группы при одном и том же углеродном атоме, с отщеплением воды переходят в более устойчивые карбонильные или карбоксильные соединения соответственно:
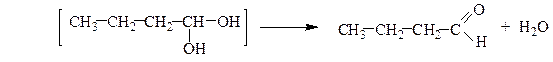
масляный альдегид
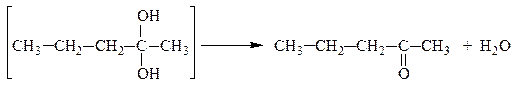
пентанон-2
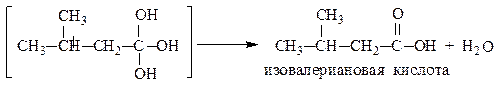
Номенклатура.При составлении рациональных названий обычно спирты рассматривают как замещенный метиловый спирт (карбинол). Названия радикалов перечисляют по старшинству (по мере увеличения количества атомов углерода и степени разветвленности). В случае одинаковых радикалов используют умножающие приставки (ди- и три-). Как видно из названий приведенных соединений по IUPAC, их получают из названий углеводородов, соответствующих длине главной углеродной цепи с добавлением суффикса «-ол», с указанием числа гидроксильных групп (диол, триол и т.д.) и цифр, указывающих на их положение в цепи (или в цикле).
Изомерия.
1. Изомерия углеродного скелета:
СH3–CH2–CH2–CH2–OH СH3–CH–CH2–OH
│
СH3
бутиловый спирт изобутиловый спирт
2. Изомерия положения гидроксильной группы или изомерия взаимного
расположения нескольких гидроксильных групп:
СH3–CH2–CH2–CH2–OН 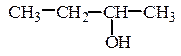
бутанол-1 бутанол-2
3. Изменение порядка связей между атомами в молекуле может привести к
образованию изомерных веществ, принадлежащих различным классам
органических соединений:
CH3–CH2–OH CH3–O–CH3
этиловый спирт диметиловый эфир
4. Пространственная изомерия (цис-транс-изомерия), как например:

цис-2-метилциклопентанол-1 транс-2-метилциклопентанол-1
Способы получения
1). Из оксида углерода (II) и водорода(катализаторы: Cr2O3, ZnO, Fe, Co)
катализатор
n CO + 2 n H2 ¾¾¾¾® CnH2n+1OH + (n-1) H2O
t
2). Гидратация алкенов – присоединение воды по двойной связи по правилу Марковникова: атом водорода присоединяется к более гидро-генизированному, а гидроксильная группа – к менее гидрогенизированному атому углерода при двойной связи; реакция АЕ протекает через образование карбкатиона, легкость образования и стабильность которого уменьшается в ряду: третичный > вторичный > первичный:
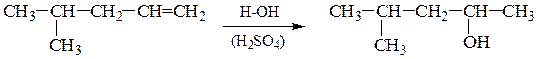
Гидратация протекает в присутствии катализаторов – Al2O3 , H3PO4, H2SO4.
3). Гидроборирование-окисление – является примером присоединения воды по двойной связи, но в отличие от классической гидратации, присоединение к несимметричным алкенам происходит против правила Марковникова, что дает возможность получать первичные спирты:
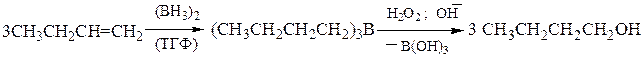
Гидроборирование-окисление осуществляется как цис-присоединение. Исходный диборан получают по реакции:
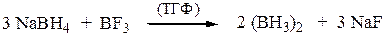
4)Гидролиз галогенопроизводных:


5) Магнийорганический синтез – удобный метод синтеза органических соединений различных классов, в котором используются доступные реактивы Гриньяра RMgX.
Первичные спирты получают реакциями с формальдегидом и окисью этилена; при этом происходит удлинение углеродной цепи на один или два атома соответственно:
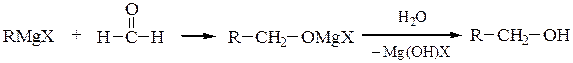
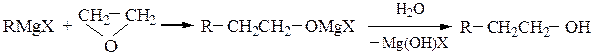
Вторичные спиртыполучают взаимодействием с альдегидами, окисями монозамещенных этиленов или с производными муравьиной кислоты:
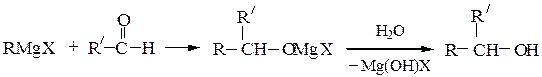
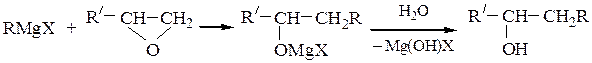
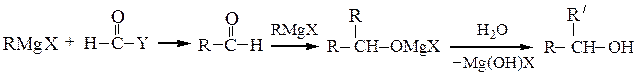
Третичные спиртыполучают из кетонов или сложных эфиров:
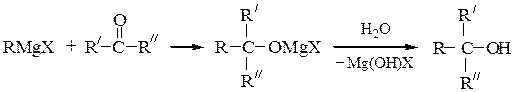
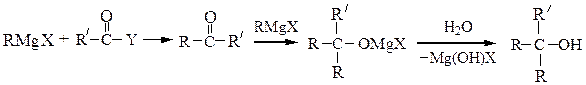
(где Y = OR'')
При получении третичных спиртов на последней стадии следует учитывать легкость их дегидратации в сильно кислой среде до алкенов.
6) Гидролиз сложных эфировв кислой или щелочной среде приводит к спиртам и карбоновым кислотам (или их солям):
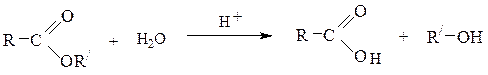
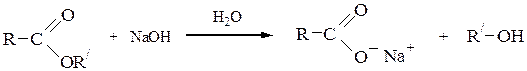
Аналогичным образомобразуется глицерин при гидролизе жиров (cм. с. ).
7) Восстановление альдегидов приводит к первичным спиртам, кетонов –
ко вторичным спиртам.
O O ОН
║ ║ │
R–C–H —→ R–CH2–OH R–C– R —→ R–CH–R'
O
║ LiAlH4
СH3–CH2–CH2–C–H ——→ СH3–CH2–CH2–CH2–OH
масляный альдегид бутиловый спирт
O OH
║ LiAlH4 │
СH3–CH2–CH2–C–CH3 ——→ СH3–CH2–CH2–CH–CH3
пентанон-2 пентанол-2
Первичные спирты также образуются в результате восстановления карбоновых кислот или сложных эфиров:
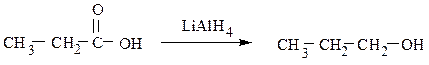
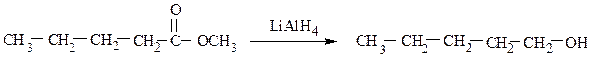
8) Промышленное получение метанола и этанола
Метанол получают из синтез-газа (катализатор – Cr2O3, ZnO; 350oC, 210 атм):
CO + 2 H2 → СН3ОН
Этанол получают прямой гидратацией этилена (катализатор – Н3РО4, SiO2; 300 oC):
CН2=CН2 + Н2О → СН3СН2ОН
или в присутствии концентрированной серной кислоты (непрямая гидратация):
CН2=CН2 + Н2О → СН3СН2ОSO3H → СН3СН2ОН
Этиловый спирт также получают ферментативным гидролизом углеводов – брожением глюкозы с помощью дрожжей рода Saccharomyces и бактерий рода Zimomonas
C6Н12О6 → 2 СН3СН2ОН + 2 СО2
9) Двухатомные спирты получают гидроксилированием производных этилена – окислением в водной среде, приводящее к образованию α-гликолей
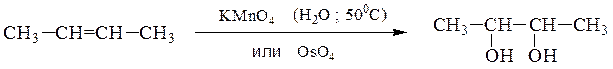
гидратацией α-окисей алкенов:
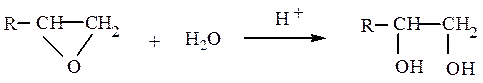
гидролизом дигалогенпроизводных или галогензамещенных спиртов слабым раствором щелочи:
СlCH2CH2Cl + 2 NaOH ¾® НOCH2CH2OH + 2 NaCl
СlCH2CH2CH2CH2OH + NaOH ¾® НOCH2CH2CH2CH2ОН
10) Глицеринсинтезируют либо из пропилена по следующим схемам:
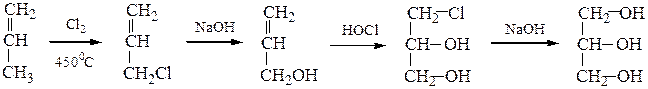
│ ↑
│________ Сl2 __________CH2–CH–CH2 _________________│
│ │ │
OH OH OH
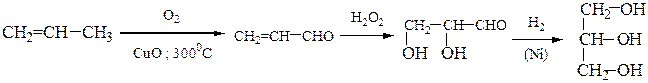
или в результате гидролиза жиров в кислой или в щелочной среде:
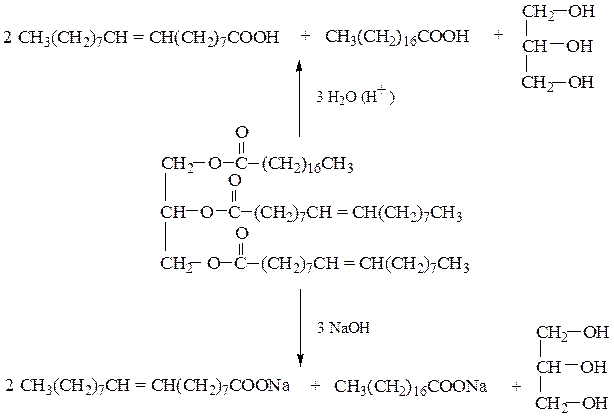
Синтезы фенолов
а) В промышленности обычно получают фенол по методу Хока – окислением изопропилбензола (метод Хока)
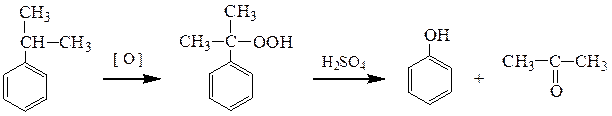
б) Фенолы могут быть получены сплавлением натриевых солей ароматических сульфокислот с гидроксидами щелочных металлов

в) В жестких условиях (350 0С и повышенном давлении) реакцией замещения галогена в арилгалогенидах на гидроксигруппу
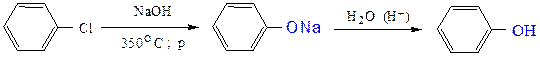
в) Гидролизом солей арилдиазония
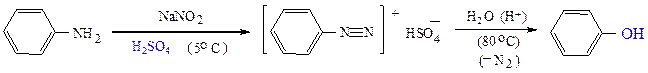
Физические свойства.Эти свойства спиртов зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – это жидкости, высшие спирты – твердые вещества.Спирты и фенолы имеют более высокие температуры кипения и плавления,чем соответствующие им углеводороды и галогенопроизводные. Это объясняется тем, что молекулы спиртов ассоциированы за счет образования водородных связей.
:O–Н …. :O–Н …. :O–Н
½ ½ ½
Ассоциаты спиртов имеют следующее строение: R R R
Ассоциация молекул спиртов за счет водородных связей определяется высокой полярностью связи О–Н из-за сильного различия в электроотрицатель-ности атомов кислорода и водорода. Энергия водородной связи (Н....О) составляет 20 кДж/моль, т.е. существенно меньше, чем ковалентной связи Н-О (460 кДж/моль). Тем не менее разрушение водородных связей, которое должно предшествовать испарению веществ при кипении, требует определенных энергетических затрат, что и выражается в повышении температуры кипения. Многоатомные спирты в еще большей степени ассоциированы, т. к. содержат большее число гидроксильных групп, участвующих в образовании водородных связей. Благодаря этому они обладают еще более высокими температурами кипения, а также повышенной растворимостью в воде.
Спирты нормального строения кипят при более высокой температуре, чем разветвленные. Низшие спирты (метанол, этанол, пропанолы) смешиваются с водой в любых соотношениях. С ростом молярной массы растворимость спиртов в воде резко падает. Высшие спирты не растворяются в воде. Растворимость спиртов с разветвленной структурой выше, чем у спиртов, содержащих нормальные радикалы.
Химические свойства.
Химические свойства спиртов определяет функциональная группа – гидроксил. Спиртам характерны разрушение одной из двух связей: С–ОН с отщеплением гидроксила или О–Н с отрывом водорода. Полярный характер связей С–О и О–Н способствует гетеролитическому разрыву и протеканию реакций по ионному механизму. Это могут быть реакции замещения, в которых происходит замена ОН или Н, или элиминирования, когда отщепляется молекула воды (дегидратация) и образуется двойная связь.
Таблица 11. Физические свойства спиртов и фенолов
| Название спирта | Формула | Мол. масса | Т.пл./т.кип. 0С | ρ, г . см-3 | Растворимость 200,100 г воды |
| метиловый этиловый пропиловый изопропиловый бутиловый вторбутиловый третбутиловый изобутиловый амиловый изоамиловый вторамиловый пентанол-3 третамиловый неопентиловый гексанол-1 гептанол-1 октанол-1 деканол-1 додециловый (лауриловый) тетрадециловый (миристиновый) гексадециловый (цетиловый) аллиловый кротиловый циклопентанол циклогексанол бензиловый α-фенилэтиловый β-фенилэтиловый дифенилкарбинол (бензгидрол) трифенилкарбинол коричный этиленгликоль глицерин фенол о-крезол п-крезол м-крезол пирокатехин резорцин гидрохинон | СН3ОН СН3СН2ОН СН3СН2СН2ОН СН3СН(ОН)СН3 СН3СН2СН2СН2ОН СН3СН(ОН)СН2СН3 (СН3)3СОН (СН3)2СНСН2ОН СН3(СН2)3СН2ОН (СН3)2СНСН2СН2ОН СН3СН(ОН)СН2СН2СН3 СН3СН2СН(ОН)СН2СН3 СН3СН2С(СН3)2(ОН) (СН3)3ССН2СОН СН3(СН2)4СН2ОН СН3(СН2)5СН2ОН СН3(СН2)6СН2ОН СН3(СН2)8СН2ОН СН3(СН2)10СН2ОН СН3(СН2)12СН2ОН СН3(СН2)14СН2ОН СН2=СНСН2ОН СН3СН=СНСН2ОН С6Н5СН2ОН С6Н5СН(ОН)СН3 С6Н5СН2СН2ОН (С6Н5)2СНОН (С6Н5)3СОН С6Н5СН=СНСН2ОН НОСН2СН2ОН НОСН2СН(ОН)СН2ОН С6Н5ОН 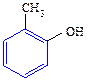 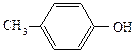 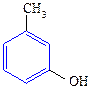 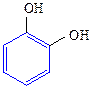 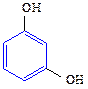 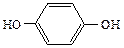 | -98 / 65 -115 / 78 -126 / 92 -88,5 / 82 -90 / 118 -115 / 99 25,5 / 83 -108/ 108,5 -78,5 / 138 -117/ 130,5 т.пл.119 т.пл.116 -12 / 102 53 / 114 -52 / 156 -34 / 176 -17 / 195 6 / 228 24 / — 38 / — 49 / — -129 / 97 118 / — 140 / — 24 / 161,5 -15 / 205 — / 205 -27 / 221 69 / 298 162,5 / — 33 / 258 -17 / 197 18/290(разл.) 43 / 181 30 / 191 35,5 / 201 11 / 201 105 / 245 110 / 281 170 / 285 | 0,792 0,789 0,804 0,786 0,810 0,808 0,789 0,801 0,814 0,812 0,819 0,815 0,809 0,812 0,820 0,822 0,825 0,829 0,900 0,853 0,949 0,962 1,046 1,013 1,02 1,115 1,261 1,05 (450) 1,048 1,034 1,034 | неограниченно неограниченно неограниченно неограниченно 8 г 12,5 неограниченно 10,2 2,3 12,5 0,6 0,2 0,06 г неограниченно 16,6 1.6 0,05 неограниченно неограниченно 9,2 2,5 2,3 2,6 |
Схема 9. Строение спиртов, их химические связи и основные типы реакций
окисление дегидратация кислотные свойства
нуклеофильное 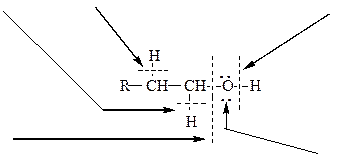
замещение нуклеофильные свойства
(основные свойства)
Схема 10. Строение фенолов, их химические связи и основные типы реакций
нуклеофильное замещение
при ненасыщенном нуклеофильные свойства кислотные свойства,
атоме углерода (основные свойства) окисление
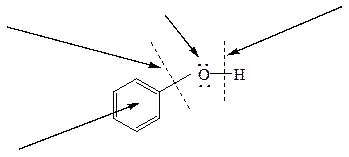
электрофильное замещение
водорода в ароматическом кольце.
1) Разрыв О–Н –связи:
а)Кислотные свойства спиртов и фенолов выражаются равновесием  . Гидроксил проявляет здесь очень слабые кислотные свойства (равновесие сдвинуто влево). Кислотные свойства спиртов зависят от природы углеводородного радикалаR товства спиртов определяен, что используется, в частности, при ситезе простых эфиров по Вильямсонуа в результате отрицате, с которым связан гидроксил. Кислотность первичных спиртов меньше кислотности воды (но того же порядка). У третичных спиртов она еще меньше, так как алкильные группы своим + Iэфф уменьшают полярность связи О-Н и подавляют ее склонность к диссоциации.
. Гидроксил проявляет здесь очень слабые кислотные свойства (равновесие сдвинуто влево). Кислотные свойства спиртов зависят от природы углеводородного радикалаR товства спиртов определяен, что используется, в частности, при ситезе простых эфиров по Вильямсонуа в результате отрицате, с которым связан гидроксил. Кислотность первичных спиртов меньше кислотности воды (но того же порядка). У третичных спиртов она еще меньше, так как алкильные группы своим + Iэфф уменьшают полярность связи О-Н и подавляют ее склонность к диссоциации.
Таким образом, реакционная способность спиртов как кислот уменьшается в ряду: метанол > первичные > вторичные > третичные.
Введение в радикал электроноакцепторных заместителей (С1, NО2 и др.) усиливает кислотные свойства в результате - Iэфф.
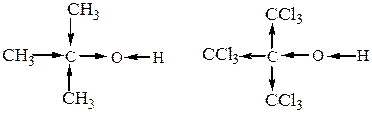
Повышенной по сравнению со спиртами кислотностью обладают и фенолы. Здесь неподеленная пара электронов кислородного атома вступает в сопряжение с p-электронной системой ароматического кольца. В результате электронная плотность кислородного атома частично перемещается на связь С-О, увеличивая при этом электронную плотность в бензольном ядре (особенно в о- и п-положениях). Электронная пара связи О-Н сильнее притягивается к атому кислорода, способствуя созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде протона. Второй причиной повышенной кислотности фенола является особая устойчивость фенолят-аниона, образующегося после отщепления протона. Эта устойчивость является следствием делокализации отрицательного заряда:
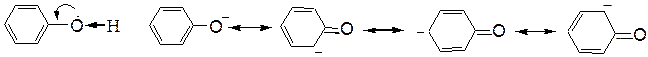
При взаимодействии кислорода с p-электронной системой ароматического ядра наблюдается мезомерный эффект – растекание электронной плотности по всей сопряженной системе. Отдавая электроны, кислород проявляет положительный мезомерный эффект (+М эфф.).
б) Расщепление связи О–Н происходит и при образовании алкоголятов в результате взаимодействия спиртов с активными металлами.
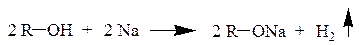
2 R–OH + Ca → (R–O)2Ca + H2 ↑
Реакционная способность падает в ряду: метанол – первичный спирт – вторичный спирт – третичный спирт (согласно ряду кислотности спиртов).
Многоатомные спирты реагируют по схеме:
CH2 –CH2 Na CH2 –CH2 Na CH2 –CH2
│ │ ——→ │ │ ——→ │ │
OH OH OH ONa ONa ONa
В случае более кислых фенолов образование фенолятов возможно также и при растворении в водных растворах щелочей:
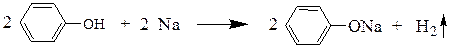
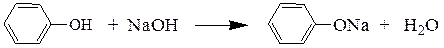
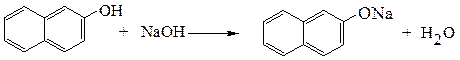
При наличии в ароматическом кольце электроноакцепторных заместителей кислотность фенолов еще более увеличивается.
В ходе этой реакции образуется алкоголят-анион, являющийся сильным нуклеофильным реагентом, что используется, в частности, при синтезе простых эфиров по Вильямсону (R' – не третичный радикал):

Алкоголяты и феноляты щелочных металлов будучи производными очень слабых кислот легко гидролизуются, причем гидролиз усиливается нагреванием:
R–ONa + H2O ¾® R–OH + NaOH
Спирты или фенолы легко вытесняются из этих соединений также действием более сильных кислот, например хлороводородной или даже угольной:
R–ONa + HCl ¾® R–OH + NaCl
2 R–ONa + CO2 + H2O ¾® 2 R–OH + Na2CO3
Этими свойствами пользуются, если надо разделить смесь нерастворимых в воде спиртов и фенолов: смесь обрабатывают водным раствором щелочи. Слой нерастворимого в воде спирта отделяют от щелочного водного раствора фенолята и последний подкисляют. В результате последней операции выделяется фенол.
Алкоголяты – твердые соединения; используются в качестве конденсирующих реагентов, т.к. являются более сильными основаниями, чем гидроксил-анион.
в) Легко протекает взаимодействие спиртов с магнийорганическими соединениями:
R–OH + R'–MgBr ¾® R'–H + Mg(OR)Br
Эта реакция лежала в основе количественного определения активного водорода в веществах по методу Церевитинова-Чугаева, путем измерения объема выделившегося газообразного углеводорода.
г) Спирты реагируют с кислотами, образуя эфиры:
на холоду
СН3СН2ОН + H2SO4 ¾¾¾® СН3СН2ОSO2OH + H2O
этилсерная кислота
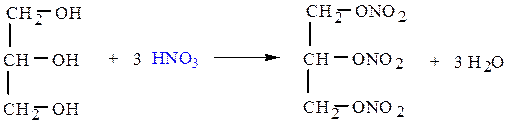
тринитроглицерин
Реакция карбоновых кислот со спиртами приводит к синтезу сложных эфиров и называется реакцией этерификации:

метиловый эфир
пропионовой кислоты
(метилпропионат)
Карбоновые кислоты ацилируют спирты с хорошими выходами только в случае первичных спиртов. Катализаторы – НС1, H2SO4, BF3. (Подробнее о
реакции этерификации см. раздел «Карбоновые кислоты», другие методы ацилирования спиртов в сложные эфиры см. раздел «Сложные эфиры»).
Дегидратация
а) Внутримолекулярная дегидратация одноатомных спиртов приводит к алкенам, при этом соблюдается правило Зайцева: атом водорода отщепляется преимущественно от соседнего наименее гидрогенизированного атома углерода; образующийся алкен наиболее замещен у двойных связей:
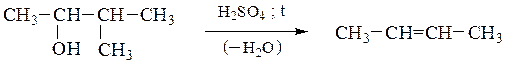
Способность спиртов подвергаться внутримолекулярной дегидратации уменьшается в ряду третичный спирт > вторичный спирт > первичный спирт в соответствии с легкостью образования и устойчивостью соответствующих карбкатионов.
б) Межмолекулярная дегидратация одноатомных спиртов дает симметричные простые эфиры (≤ 140 0C; H2SO4):
R–OH + HO–R → R–O–R + H2O
Так, образование дибутилового эфира из бутанола-1 проходит по следующему механизму:
