Лекция № 10. Растворы электролитов. Теория электролитической диссоциации
Электролитами называются сложные вещества, растворы и расплавы которых проводят электрический ток. Исследования показали, что физико-химические свойства растворов электролитов подчиняются законам Вант-Гоффа и Рауля, если в формулы последних ввести специальный множитель (i), получивший название изотонического коэффициента:
p = i×1000CRT; i×Dp/p0 = a; Dtзам = i×KCm; Dtкип = i×ECm
Изотонический коэффициент принимает значения больше единицы и при очень больших разбавлениях стремится к целочисленным значениям, равным сумме стехиометрических индексов в формуле вещества, например, к 2 для NaCl или к 3 для Na2SO4.
Коллигативные свойства растворов не зависят от природы растворенного вещества, а определяются только концентрацией его частиц. Таким образом, если значения p, Dp, Dtзам, Dtкип для растворов электролитов выше, чем для растворов неэлектролитов той же концентрации, то число частиц в растворах электролитов больше. Объясняя это явление, шведский химик С. Аррениус (1887 г.) разработал теорию электролитической диссоциации, основные положения которой можно сформулировать следующим образом:
1. Электролиты в растворах или расплавах распадаются на ионы. Процесс распада электролита на ионы под действием растворителя в растворах или высокой температуры в расплавах называется электролитической диссоциацией.
2. Процесс электролитической диссоциации может быть обратим, наряду с диссоциацией может происходить образование молекул растворенного вещества из его ионов. Например, в растворе уксусной кислоты наряду с диссоциацией
CH3COOH ® CH3COO- + H+
происходит обратный процесс
CH3COO- + H+ ® CH3COOH
Суммарное уравнение будет иметь следующий вид:
CH3COO- + H+  CH3COOH
CH3COOH
Причиной диссоциации может быть как разделение ионов под действием растворителя, так и их образование в результате реакции с молекулами растворителя (ионизация), например:
HCl + H2O ® H3O+ + Cl-; NH3 + H2O  NH4+ + OH-
NH4+ + OH-
Как обратимый процесс диссоциация может быть охарактеризована соответствующей константой - константой диссоциации или в более общем виде константой ионизации.
 ;
; 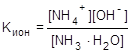
Количественно процесс диссоциации характеризуется степенью диссоциации (a) - отношением количества электролита, распавшегося на ионы, к общему количеству вещества в растворе.
Для того чтобы связать степень диссоциации с изотоническим коэффициентом, рассчитаем количество частиц, образовавшихся при диссоциации одного моля электролита на k ионов:
i = (1 - a) + ak; 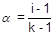
На степень и константу диссоциации влияет ряд факторов: природа электролита и растворителя, концентрация и температура. Обычно степень диссоциации увеличивается с увеличением полярности молекул электролита и растворителя. Для водных растворов сильными электролитами являются те вещества, у которых в 0,01 н. растворе кажущаяся степень диссоциации больше 0,3 (30%) или Кдисс > 1×10-2. К сильным электролитам относятся все сильные кислоты (HCl, HClO4, HNO3, H2SO4 и т.д.) и щелочи (NaOH, KOH, Ca(OH)2 и т.д.), а также подавляющее большинство солей.
Электролиты, для которых в 0,01 н. растворе 0,3>a>0,03 или 1×10-2>Кдисс>1×10-4, относят к электролитам средней силы. Примерами электролитов средней силы могут служить фосфорная кислота - H3PO4 при диссоциации по первой ступени и муравьиная кислота - HCOOH.
И, наконец, электролиты, для которых a<0,03 (для 0,01 н. раствора) и Кдисс<1×10-4, называются слабыми. Слабыми электролитами являются слабые кислоты (HF, HClO, H2CO3, H2SO3 и др.) и малорастворимые основания, а также некоторые соли, например, HgCl2.
Изменение концентрации не влияет на величину константы диссоциации, как и константы любого другого равновесия, но значительно влияет на степень диссоциации. Проследим это влияние на примере уксусной кислоты:
CH3COO- + H+  CH3COOH
CH3COOH
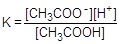
Выразим равновесные концентрации частиц в растворе через общую концентрацию уксусной кислоты (С):
[CH3COO-] = [H+] = Ca; [CH3COOH] = C - Ca = C(1-a)
Подставив полученные формулы в выражение константы диссоциации, получим следующее выражение

Так как для слабых электролитов a<<1, выражение можно привести к более простому виду:
K » Ca2, отсюда 
Полученное уравнение представляет собой аналитическое выражение закона разбавления Оствальда: с увеличением разбавления (уменьшением концентрации) степень диссоциации слабого электролита увеличивается.
Влияние температуры на степень диссоциации для сильных и слабых электролитов проявляется по-разному:
ü Для слабых электролитов увеличение температуры приводит увеличению степени диссоциации. Электролитическая диссоциации - процесс эндотермический, и согласно принципу Ле Шателье, увеличение температуры смещает равновесие диссоциация  моляризация в сторону процесса диссоциации.
моляризация в сторону процесса диссоциации.
ü Для сильных электролитов увеличение температуры приводит к уменьшению кажущейся степени диссоциации, так как увеличивается хаотичность движения ионов, затрудняющая их перемещение.
Для сильных электролитов реальная степень диссоциации равна единице. Однако, высокая концентрация ионов приводит к тому, что в растворе каждый из них окружен атмосферой из ионов противоположного знака, что препятствует их перемещению. При измерении какого-либо физического свойства, например электропроводности, получают заниженные значения.
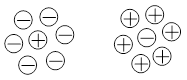
Таким образом, наблюдаемая или кажущаяся степень диссоциации получается меньше единицы, а эффективная концентрация ионов занижена. Поэтому для растворов сильных электролитов необходимо пользоваться не реальной, а эффективной концентрацией частиц. Эффективная концентрация частицы, с которой она проявляет себя в растворе, называется активностью (а). Активность иона связана с его концентрацией простым соотношением: а = f×C, где f - коэффициент активности. Для разбавленных растворов электролитов (до 0,01 моль/л) расчет коэффициента активности выполняют по следующей формуле:
 ,
,
где z - заряд иона, m - ионная сила раствора:
m = 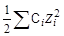
Рассчитаем в качестве примера активности ионов в 0,01 М растворе сульфата калия.
Сульфат калия, как сильный электролит, диссоциирует в растворе нацело
K2SO4 = 2K+ + SO42-
Из уравнения диссоциации следует, что [K+] = 0,02 М, а [SO42-] = 0,01 М. Рассчитаем ионную силу раствора, а затем коэффициенты активности и активности ионов.
m = 1/2(0,02×12 + 0,01×22) = 0,03 моль/л;
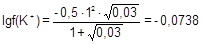 ; f(K+) = 0,844; a(K+) = 0,01688 моль/л;
; f(K+) = 0,844; a(K+) = 0,01688 моль/л;
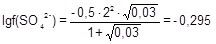 ; f(SO42-) = 0,507; a(SO42-) = 0,0507 моль/л
; f(SO42-) = 0,507; a(SO42-) = 0,0507 моль/л
Литература: [1] с. 223 - 234; [2] с. 281 - 296
