Правила по технике безопасности при работе с электроприборами
1. Работу с приборами можно начинать только после тщательного ознакомления с инструкцией по их эксплуатации.
2. Используйте только исправное оборудование, изоляция электроприборов не должна иметь видимых повреждений. Коммутационные устройства (штепсельные розетки и вилки) должны быть исправны.
3. Включать приборы только в сеть переменного тока с напряжением 220 В.
4. При включении и выключении электроприборов необходимо браться за вилку, а не за шнур.
5. Электроприборы должны располагаться на лабораторном столе таким образом, чтобы химические реактивы не попадали на них, а также в электрическую розетку.
6. на рабочем столе около горячей электроплитки не должны находится сумки, тетради и др.
7. Если произошло замыкание электроустановки или возник пожар, необходимо немедленно обесточить прибор. Тушить пожар следует песком и огнезащитной тканью.
8. Приборы должны иметь рабочую изоляцию, элемент для заземления.
9. В электроприборах имеются элементы, находящиеся под напряжением, поэтому запрещается самостоятельно вскрывать и ремонтировать их, а также работать с неисправными приборами.
10. В случае получения термического ожога, обожженное место следует присыпать бикарбонатом натрия (питьевая сода), крахмалом, тальком или сделать примочку свежеприготовленным 2%-ным раствором соды, перманганатом калия или неразбавленным этиловым спиртом.
11. После окончания работы необходимо отключить прибор от сети.
12. При работе с диапроектором необходимо соблюдать следующие меры предосторожности:
§ включать диапроектор необходимо только в сеть переменного тока с напряжением 220 В;
§ производить установку лампы, а также замену лампы и предохранителя при отключенном от сети диапроекторе;
§ при замене лампы не вынимайте ее из патрона сразу после выключения диапроектора из сети, так как лампа нагревается во время работы до высокой температуры;
§ если вентилятор не работает, немедленно отключите диапроектор от сети.
Глава 1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Лабораторная работа № 1
Определение энтальпии реакции (DНпр) нейтрализации
и расчет термодинамических функций (DНотеор., DSотеор., DGотеор.)
Цель и ход работы:
1. Ознакомиться с теоретической частью и математическими формулами расчета теплового эффекта и термодинамических функций.
2. Иметь понятие о калориметрии и калориметре
3. Определить градиент температур при протекании определенного химического процесса.
4. Внести полученные данные в протокол.
5. Рассчитать по экспериментальным данным величину теплового эффекта и изменения энтальпии химической реакции.
6. Сравнить экспериментальные и теоретические величины изменения энтальпии и рассчитать относительную погрешность определения энтальпии.
7. С помощью справочных данных определить изменение энтропии и свободной энергии Гиббса в химическом процессе.
8. Сделать вывод о термодинамике химического процесса по полученным и рассчитанным данным.
Теоретическая часть
Термодинамика изучает энергетические изменения в физических и химических процессах и устанавливает возможность самопроизвольного течения процесса в данном направлении. Термодинамическое состояние веществ определяется, прежде всего, их природой, агрегатным состоянием, температурой, а также составом и концентрацией растворов. В термодинамике изменение энергетического состояния системы описывается величиной энтальпии Н, характеризующей теплосодержание системы. В термохимии в отличие от термодинамики энергию, выделяющуюся в виде теплоты, считают положительной, а подводимую к системе – отрицательной. Если теплота реакции измерена при постоянных давлении и температуре, то она равна убыли энтальпии Qр=-DH. В термохимических уравнениях необходимо указать тепловые эффекты химических реакций (изменение энтальпии), агрегатное состояние каждого из исходных веществ и продуктов реакции.
Согласно закону Г.И.Гесса (1841 г.) тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
Например, диоксид азота может быть получен при непосредственном взаимодействии кислорода и азота
½ N2(г) + O2(г) = NO2(г) DH1 = 33,5 кДж
или в результате прохождения следующих последовательных стадий:
½ N2(г) + ½ O2(г) = NO(г) D H2 = 90,2 кДж
NO(г) + ½ O2(г) = NO2(г) DH3 = – 56,7 кДж .
Изменение энтальпии в первом процессе равно сумме изменений энтальпии в двух других
D H1 = DH2 + DH3 .
Вместо выражения “изменение энтальпии в процессе” в учебной и научной литературе употребляют более краткое выражение “энтальпия процесса”. Температуру, при которой определена энтальпия процесса, указывают в виде нижнего правого индекса (D H298).
Тепловые эффекты, сопровождающие химические реакции, измеряют в специальных приборах, называемых калориметрами.
Количество теплоты, выделяющейся или поглощающейся в калориметре, определяется по формуле
Q = (Тк – Тн) SС, (1)
гдеТк–конечная температура системы, К; Тн–начальная температура системы, К;
åС –теплоемкость системы, включающая теплоемкость калориметрического сосуда, калориметрической жидкости и вещества.
Теплоемкость тела определяется как отношение количества теплоты (DQ), сообщенной телу или системе в каком-либо процессе, к соответствующему изменению температуры тела.
Теплоемкость зависит от массы тела, его химического состава, термодинамического состояния и вида сообщенной теплоты.
Молярная теплоемкость (Ст), определяемая как отношение количества теплоты (DQ), сообщенной системе в каком-либо процессе, к 1 молю вещества при нагревании на 1 К, определяется по формуле
 , (2)
, (2)
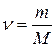 , (3)
, (3)
где n – количество вещества; DТ – изменение температуры;
m – масса вещества; М – молярная масса вещества.
Размерность Ст, Дж/моль×К.
Удельной теплоемкостью (с) называется теплоемкость единицы массы однородного вещества при нагревании его на 1 К. Удельная теплоемкость определяется по формуле
 . (4)
. (4)
Размерностьс, Дж/кг×К.
Теплоемкость системы SС находится из математического выражения
SС = с1т1 + с2т2 , (5)
где с1 и т1 – удельная теплоемкость и масса реакционного сосуда,
с2 и т2 – удельная теплоемкость жидкости (раствора), помещенной
в калориметр и масса раствора и вещества.
Масса раствора определяется по формуле
m = V × r, (6)
где V – объем раствора, r – плотность раствора.
При использовании стеклянного реакционного сосуда теплоемкостью калориметрического сосуда можно пренебречь из-за его малой теплопроводности. Удельную теплоемкость растворов и их плотность можно принять равными этим величинам для воды. Таким образом, в уравнении (5) выражением (с1×т1) пренебрегаем, а величина с2 приравнивается к теплоемкости воды  = 4,2 кДж/кг×К (или кКал/кг×С).
= 4,2 кДж/кг×К (или кКал/кг×С).
В этом случае уравнение (1) принимает вид
Q = 4,2(Тк – Тн) × m2.(7)
Для каждого опыта значение т2 определяется из массы веществ, помещенных в реакционный сосуд калориметра.
Расчет изменения энтальпии (DН) с помощью теплового эффекта проводится по формуле
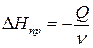 , (8)
, (8)
где n –количество вещества, моль.
Для термохимических расчетов важна энтальпия образования соединений, получаемая из простых веществ при данной температуре. Энтальпия образования – это теплота, необходимая для образования 1 моля вещества
Пример: Н2 (г) +1/2О2 (г) = Н2О (ж) DНо = DНообр.(Н2Ож).
Стандартная энтальпия образования DНообр.относится к процессам, в которых все вещества находятся в стандартных условиях: Т = 298 К, Р = 101,3 кПа, с = 1 моль.
На основании следствия из закона Гесса можно рассчитать изменение энтальпии химической реакции по формуле
DНотеор. = å ni ×DH°обр. (продуктов р-ции) – å ni × DHо обр.(исходных в-в), (9)
где DНотеор.-энтальпия изучаемого процесса, в частности, химической реакции.
Первый член в правой части уравнения представляет собой сумму энтальпии образования продуктов реакции, взятых с учетом стехиометрических коэффициентов в уравнении реакции. Второй член – аналогичная сумма для исходных веществ.
Закон Гесса дает возможность оперировать с термохимическими уравнениями, как с алгебраическими – складывать, вычитать, делить и умножать обе части на постоянное число.
Для абстрактной реакции aA + bB = dD + eEизменение энтальпии(DH) определяется следующим образом:
DHотеор.= (d DH обр.D + e DH обр.E ) – ( a DH обр.A + bDH обр.B ) . (10)
Закон сохранения энергии и следствия из него позволяют представить энергетический баланс реакций, но направление самопроизвольного протекания реакции определить из них невозможно. Функции состояния системы DHиDUтакже не дают возможность судить о направлении процесса, они указывают на энергетические изменения, происходящие в системе. Для суждения о направлении протекания процесса необходимо ввести новую функцию, названную энтропией. Опытные данные показывают, что все самопроизвольные процессы в изолированных системах протекают в сторону увеличения беспорядка. Критерием направленности процесса может служить степень неупорядоченности системы. Мерой этой неупорядоченности является функция S, которая называется энтропией.
Изменение энтропии любого химического процесса можно определить, исходя из закона Гесса: изменение энтропии химической реакции равно разности сумм энтропий продуктов реакции и исходных веществ
S = å ni ×S (продуктов р-ции) – å ni × S(исходных в-в). (11)
Например, для реакции aA + bB = dD + eE
DS = (dSD + eSE) – (aSA + bSB).
Возможность самопроизвольного протекания процесса определяют, исходя из II закона термодинамики: в изолированной термодинамической системе самопроизвольно протекают те процессы, в том числе химические, в которых происходит повышение энтропии (DS >0).
Устойчивость любой системы, в том числе и химической, определяется соотношением энтальпийного (DН) и энтропийного (ТDS) факторов. Функция, объединяющая эти факторы, названа свободной энергией Гиббса (G). Она является мерой устойчивости системы при постоянном давлении (Р = const) и температуре (Т = const). Изменение свободной энергии Гиббса (DG), следовательно, зависит от изменений двух термодинамических функций энтальпии (DH) и энтропии (DS)
DG=DH-TDS, (12)
где T – температура, К.
Судить о возможности самопроизвольного протекания процесса можно по знаку величины свободной энергии Гиббса.
1) При DG < 0 процесс термодинамически возможен.
2) При DG > 0 протекание процесса термодинамически невозможно.
3) При DG = 0 система находится в состоянии химического равновесия.
Следовательно, все процессы могут самопроизвольно протекать только в сторону уменьшения свободной энергии Гиббса.
Экспериментальная часть
Оборудование и реактивы
Оборудование: керамические стаканы, ртутный или спиртовой термометр.
Реактивы: 1 н HCl, 1 н NaOH, 1 М BaCl2, 1 М Na2SO4,
Mg, Zn, NH4NO3(кр) или КNO3(кр)
Калориметрия. Калориметр
Калориметрия является одним из самых точных физико-химических методов исследования. Современные калориметрические установки обладают термометрической чувствительностью10-6…10 -5 К. Основным узлом калориметра является калориметрический сосуд, снабженный термометром сопротивления и нагревателем. Калориметрический сосуд имеет оболочку, которая нужна для точного учета теплообмена между калориметром и окружающей средой.
Упрощенный вариант калориметра представляет собой два керамических стакана различного объема. В крышку меньшего по объему стакана вставляется термометр для измерения температуры находящейся в стакане жидкости.
Запишите уравнение химической реакции.
Отмерьте в стакан с помощью бюретки 25 мл 1 М раствора соляной кислоты. В другой стакан налейте 25 мл 1 М раствора гидроксида натрия. Стакан с раствором NaOHпоместите в простейший калориметр, плотно закройте его крышкой с двумя отверстиями. В одно из отверстий вставьте термометр (с ценой деления 0,1 оС) и через 5…6 минут зафиксируйте температуру щелочи. Затем через воронку, вставленную в другое отверстие, налейте раствор отмеренной соляной кислоты и измерьте максимальную температуру раствора с точностью до 0,1 оС.
Результаты экспериментального определения энтальпии нейтрализации представьте в форме протокола.
 Протокол опыта
Протокол опыта
Концентрация соляной кислоты (С,моль/л) –
Объем соляной кислоты (V, мл) –
Плотность соляной кислоты (r, г/см3) –
Масса раствора соляной кислоты (m, г) –
Концентрация гидроксида натрия (См, моль/л) –
Объем гидроксида натрия (V, мл) –
Плотность гидроксида натрия (r, г/см3) –
Масса гидроксида натрия (m, г) –
Начальная температура (Тн,К) –
Конечная температура (Тк,К) –
Тепловой эффект нейтрализации (Q, кДж) –
Изменение энтальпии процесса в данной системе (DHпр., кДж/моль) –
Теоретическое значение изменения энтальпии процесса (DHотеор, кДж/моль) –
Ошибка измерения энтальпии процесса нейтрализации (П, %) –
Теоретическое значение измерения энтропии процесса(DSотеор., Дж/моль×К) –
Теоретическое значение изменения свободной энергии Гиббса
(DGотеор., кДж/моль) –
 По уравнению (7) рассчитайте величину теплового эффекта процесса нейтрализации (Q). Для данной системы, состоящей из двух растворов, массу этих растворов определяют с учетом плотности растворов, которая приводится в табл. 1 (с. 15).
По уравнению (7) рассчитайте величину теплового эффекта процесса нейтрализации (Q). Для данной системы, состоящей из двух растворов, массу этих растворов определяют с учетом плотности растворов, которая приводится в табл. 1 (с. 15).
Результаты измерения подставьте в формулу
Q = 4,2(Тк – Тн) × (V1 × r1 + V2 × r2), (13)
где V1 и r1– объем и плотность раствора соляной кислоты;
V2и r2–объем и плотность раствора едкого натра.
Затем на основании экспериментальных данных определяют по уравнению (8) изменение энтальпии реакции практическое (DHпр.), затем проводят теоретический расчет изменения энтальпии теоретическое (DHотеор.)по уравнению (10) с учетом значений DHообр. из табл. 2 (с.16).
Найдите относительную ошибку определения энтальпиииз математического выражения (14)
 . (14)
. (14)
Следующим этапом работы является расчет значения DSотеор. химической реакции по уравнению (11) с использованием величин Sотеор.,представленных в табл. 2. Величину DGотеор. определяют из уравнения (12), подставляя в это уравнение DНотеор. и Sотеор., рассчитанные Вами на основании табличных данных (табл. 2) для данной химической реакции. Для расчета используют стандартную температуру Т = 298 К.
Все полученные данные вносят в протокол и делают четыре вывода по величинам, найденным экспериментально (Q, DHпр.), и рассчитанным величинам (DНотеор., DSотеор., DGотеор.) о термодинамике данного химического процесса.
Таблица 1
