Химическая кинетика и химическое равновесие.
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции). В случае гомогенного процесса, протекающего при постоянном объеме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ в единицу времени. Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализатора. В тех случаях, когда для протекания реакции необходимо столкновение нескольких реагирующих частиц, зависимость скорости реакции от концентраций определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов. Так, для реакции
А + 2В = АВ2
закон действия масс можно записать
u=k[A][B]2
Химическое равновесие. Реакции, которые протекают в одном направлении и идут до конца, называются необратимыми. Большинство реакций являются обратимыми, т.е. протекают в противоположных направлениях и идут не до конца. В этом случае устанавливается подвижное химическое равновесие и скoрости прямого и обратного процессов становятся одинаковыми. Таким образом, химическое равновесие - это такое состояние системы реагирующих веществ, при котором скорости противоположных реакций равны. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными концентрациями. Изобразим обратимую реакцию в общем виде
aA + bB Û cC + dD
и выразим скорости прямой (u1) и обратной (u2) реакций.
u1 = k1[A]a[B]b и u2 = k2[C]c[D]d
При равновесии u1 = u2, а значит
k1[A]a[B]b = k2 [C]c[D]d
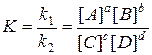 |
или
Но k1 и k2 для данной реакции при одной и той же температуре являются величинами постоянными, а значит и их отношение есть величина постоянная и называется константой химического равновесия К. Она зависит от природы реагирующих веществ и температуры, но не зависит от их концентрации. Соотношение для константы химического равновесия К есть уравнение закона действующих масс. Сам закон можно сформулировать следующим образом: в данной обратимой химической реакции при данной температуре отношение произведений равновесных концентраций веществ правой и левой частей уравнения, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная.
При изменении условий протекания реакции (температуры, давления, концентрации какого-либо из участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле-Шателье: Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено. Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты; повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ; удаление из системы одного из продуктов реакции ведет к смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных веществ приводит к сдвигу равновесия в направлении обратной реакции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Опыт 1: Влияние концентрации реагирующих веществ на скорость гомогенной химической реакции.
В четыре стакана емкостью 100 мл налить по 20 мл раствора сульфита натрия, подкисленного серной кислотой и содержащего небольшое количество крахмала (1 г соли, 0,95 мл концентрированной серной кислоты, 0,1 г крахмала в 1 л раствора). В четыре других стаканчика налить 20, 10, 5 и 2,5 мл раствора иодата калия KJO3 (3,9 г соли в 1 л раствора). В последние три из четырех стаканчиков добавить соответственно 10, 15 и 17,5 мл дистиллированной воды. Сливая попарно растворы сульфита натрия и иодата калия, отмечать по секундомеру время появления окраски. Результаты записать в таблицу:
Построить график зависимости относительной скорости реакции 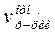 от относительной концентрации иодата калия С(KJO3)отн.. Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Отвечает ли это уравнение механизму протекания реакции? Ответ обосновать.
от относительной концентрации иодата калия С(KJO3)отн.. Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Отвечает ли это уравнение механизму протекания реакции? Ответ обосновать.
| Номер опыта | V(KJO3), мл | V(Na2SO3), мл | С(KJO3)отн. | Время t, с. | uр-цииотн., 1/c |
| 2.5 | |||||
Опыт 2: Влияние величины поверхности на скорость гетерогенной химической реакции.
В две пробирки поместить равные по массе (не более 0,3 г) образцы мела: в одну пробирку порошок, в другую - кусочек. В обе пробирки одновременно влить по 1-2 мл 2н. НСl. Сравнить скорость растворения мела в обеих пробирках. Написать уравнение реакции.
Опыт 3: Автокатализ.
Автокаталитическими называют реакции, катализатором в которых служит один из продуктов реакции. Примером является окисление щавелевой кислоты перманганатом в кислой среде:
2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2 +8H2O
Катализатором этой реакции служат ионы Мn2+. В две пробирки налить по 1-2 мл разбавленного раствора перманганата калия, подкислить раствором серной кислоты и прилить равные объемы 1М раствора щавелевой кислоты. В одну из пробирок бросить кристаллик соли марганца (II). Сравнить скорость окисления щавелевой кислоты в обеих пробирках.
Опыт 4: Смещение химического равновесия при изменении концентрации реагирующих веществ.
К 20 мл дистиллированной воды в химическом стаканчике добавить по 1-2 капли растворов хлорида железа (III) и роданида аммония. Что происходит? Написать уравнение реакции. Полученный раствор разлить в 4 пробирки (по 1-2 мл). В первую добавить несколько капель концентрированного раствора хлорида железа (III), во вторую - концентрированного раствора роданида аммония, в третью - концентрированного раствора хлорида аммония, четвертую оставить для сравнения. Как изменяется интенсивность окраски раствора в первых трех пробирках? Дать объяснение, пользуясь выражением константы равновесия и принципом Ле-Шателье.
Опыт 5: Влияние температуры на химическое равновесие.
При взаимодействии иода с крахмалом образуется вещество сложного состава - иодокрахмал. Реакция экзотермическая и равновесие ее условно представить схемой:
иод + крахмал Û иодокрахмал + Q; DНор-ции < 0
В две пробирки налить по 5 мл свежеприготовленного раствора крахмала и добавить 1-4 капли раствора иода, содержащего небольшое количество иодида калия. Что наблюдаете? Одну из пробирок нагреть и сравнить с контрольной пробиркой. Охладить нагретую пробирку водой из под крана. Сравнить с контрольной пробиркой. Результаты опыта записать в таблицу:
| Номер опыта | Изменение температуры | Изменение интенсивности окраски | Скорость какой реакции увеличилась | Направление смещения равновесия |
Опыт 6: Ингибирование коррозии.
В два стаканчика поместить стальную проволоку (скрепка, гвоздь) и прилить по несколько мл соляной кислоты. В один из стаканов добавить 1-2 мл 40%-ного раствора формалина. Сравнить скорость коррозии стали в обоих стаканчиках.
ВОПРОСЫ САМОКОНТРОЛЯ ПО ТЕМЕ
"ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ"
1. Какая реакция называется самопроизвольной? Должна ли самопроизвольная реакция обязательно быть быстропротекающей?
2. Какие реакции называются практически необратимыми (односторонними)? Приведите примеры обратимых реакций.
3. Дать определение и математическое выражение скорости химической реакции.
4. Что называется константой скорости химической реакции и от каких факторов она зависит?
5. Сформулировать закон действующих масс и привести примеры.
6. Каков физический смысл константы химического равновесия и от каких факторов она зависит?
7. Написать уравнение закона действующих масс для следующих обратимых процессов:
а) Cl2 + H2O Û Cl- + H+ + HClO;
б) mA + nB Û pC
8. Каким образом константа равновесия связана с константами скорости прямой и обратной реакции?
9. Вычислить константу химического равновесия реакции NaCl + H2SO4 Û NaHSO4 + HCl, если равновесные концентрации [NaCl] и [H2SO4] составляют по 1 моль/л, а [NaHSO4] и [HCl] - по 0,4 моль/л.
10. Сформулировать принцип Ле-Шателье.
11. Как сместить равновесие вправо:
а) 3H2 + N2 Û 2NH3; DHo < 0
б) H2 + I2 Û 2HI; DHo < 0
в) 3O2 Û 2O3; DHo > 0
г) CN- + H2O Û HCN + OH-
д) Zn2+ + H2S Û ZnS + 2H+
ЛАБОРАТОРНАЯ РАБОТА № 3
ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ.
Водородный показатель рН. Вода, являясь слабым электролитом, в очень малой степени диссоциирует на ионы:
H2O Û H+ + OH-
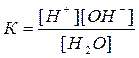
Применив к данному обратимому процессу закон действующих масс:
Приняв концентрацию воды [H2O] величиной постоянной, равной 1000/18=55,56 моль/л, уравнение можно записать так:
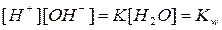
Kw - постоянная величина - называется ионным произведением воды и при 22oС равна 10-14. Для чистой воды концентрация ионов водорода равна концентрации гидроксид-ионов. Следовательно, при 22oС
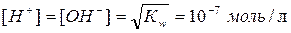
Десятичный логарифм концентрации водородных ионов, взятый с обратным знаком, называется водородным показателем и обозначается рН, т.е. рН = -lg[H+]. Понятие рН удобно применять для характеристики реакции растворов: нейтральная - рН = 7; кислая - рН < 7, щелочная - рН > 7
Гидролиз солей. Гидролизом соли называется взаимодействие ионов соли с водой, приводящее к образованию слабого электролита и (чаще всего, но не всегда) к избыточному содержанию в растворе ионов Н+ или ионов ОН-.
Различают 4 случая гидролиза:
1. Гидролиз по катиону характеризует соли, образованные сильной кислотой и слабым основанием. В этом случае катион соли связывает ионы ОН воды, что смещает равновесие системы Н2О Û Н+ + ОН- вправо. [H+] > [OH-] - среда кислая, рН < 7.
2. Гидролиз по аниону характеризует соли, образованные слабой кислотой и сильным основанием. В этом случае анион соли связывает ионы Н+ воды и в растворе накапливаются ионы ОН-. [OH-] > [H+] - среда щелочная, рН > 7.
3. Гидролиз по катиону и аниону - свойственен солям, образованным слабой кислотой и слабым основанием. Реакция растворов таких солей определяется соотношением величин констант диссоциации продуктов гидролиза.
4. Соли, образованные сильными кислотами и основаниями не содержат в своем составе ионов, способных к взаимодействию с водой, поэтому гидролизу не подвергаются.
Количественной оценкой гидролиза являются степень и константа гидролиза. Степенью гидролиза h называется отношение числа молекул, подвергшихся гидролизу, к общему числу растворенных молекул: h=cг/с. Степень гидролиза тем больше, чем больше Кw, т.е. чем больше температура (так как Кw возрастает с температурой); чем меньше Кдисс., т.е. чем слабее кислота (основание), которая образуется в результате гидролиза соли; чем меньше концентрация, т.е. чем больше разбавлен раствор.
Константой гидролиза Кг. называется отношение произведения концентраций продуктов гидролиза к концентрации негидролизованной соли. Для реакции CN- + HOH Û HCN + OH- константа гидролиза запишется в виде:
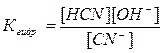
Величина Кгидр., в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является более удобной характеристикой процесса. Обе величины связаны между собой отношением:
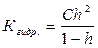
 При малых значениях h:
При малых значениях h:
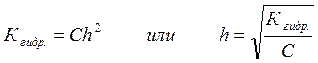

Гетерогенные равновесия. Произведение растворимости. Абсолютно нерастворимых веществ нет. Поэтому ничтожная часть даже самого нерастворимого вещества, например AgCl, все же переходит в раствор. Со временем между твердой фазой (осадком) и ионами в растворе устанавливается подвижное равновесие:
AgCl (осадок) Û Ag+ + Cl- (раствор)
Таким образом, в гетерогенной системе, состоящей из осадка и насыщенного относительно него раствора, непрерывно протекают два процесса с одинаковой скоростью: переход ионов в раствор и их осаждение на поверхности кристаллов. Произведение растворимости - постоянная величина при данной температуре - представляет собой произведение концентраций ионов в насыщенном растворе малорастворимого электролита. Обычно его обозначают символом ПР с индексом, указывающим, к какому электролиту он относится, например [Ag+][Cl-] = ПРAgCl. Надо иметь ввиду, что ПР постоянно только для насыщенных растворов малорастворимых веществ (например AgI, BaSO4, но не NaCl). ПР характеризует растворимость вещества: чем больше ПР, тем больше растворимость.
При [Ag+][Cl-] < ПРAgCl - раствор ненасыщенный,
[Ag+][Cl-] = ПРAgCl - раствор насыщенный,
[Ag+][Cl-] > ПРAgCl - раствор пересыщенный.
Добавляя к ненасыщенному раствору электролита электролит с одноименным ионом, можно превратить его в насыщенный и пересыщенный. Из понятия ПР вытекает условие образования осадков: малорастворимый электролит всегда выпадает в осадок, когда произведение концентраций ионов сделается больше величины ПР электролита, т.е. в случае AgCl, когда [Ag+][Cl-] >> ПРAgCl. Это будет достигнуто прибавлением избытка электролита, содержащего Ag+ - или Cl- -ионы. Растворение осадка происходит тогда, когда произведение концентраций ионов сделается меньше величины ПР электролита, т.е. в случае AgCl, когда [Ag+][Cl-] << ПРAgCl.Этого можно достигнуть, связывая один из ионов, посылаемых осадком в раствор. Это осуществляется образованием: 1) малодиссоциированного соединения; 2) комплексного иона; 3) менее растворимого соединения; 4) изменением заряда иона в окислительно-восстановительной реакции.
Буферные растворы. Буферные растворы - это такие растворы, рН которых почти не зависит от разбавления, концентрирования и мало изменяется при прибавлении к ним небольших количеств кислот или щелочей, не превышающих некоторого предела. Обычно буферными являются растворы, содержащие слабую кислоту и ее соль, образованную сильным основанием, или слабое основание и его соль, образованную сильной кислотой. Буферной емкостью называется число эквивалентов N кислоты или основания, необходимое для смещения рН одного литра буферного раствора на одну единицу. Она вычисляется по формуле:
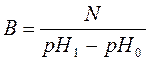
где рН0 - исходное значение, а рН1 - после добавления кислоты или щелочи. Буферная емкость раствора тем выше, чем больше концентрация компонентов и чем меньше эти концентрации отличаются друг от друга. Каждый буферный раствор имеет определенное значение рН, которое можно рассчитать, пользуясь соответствующими формулами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Опыт 1: Влияние одноименного иона на степень диссоциации слабых электролитов.
а) В пробирку налить 1-2 мл 2н. уксусной кислоты и полоской универсальной индикаторной бумаги определить рН раствора. Добавить в раствор небольшое количество кристаллического ацетата натрия, перемешать и снова определить рН. Объяснить наблюдаемые явления.
б) В пробирку налить 1-2 мл раствора аммиака и измерить значение рН полоской индикаторной бумаги. Внести в пробирку небольшое количество кристаллического хлорида аммония и хорошо взболтать и снова определить значение рН. Объяснить наблюдаемые явления.
Опыт 2: Буферные растворы.
а) Смешением равных объемов 0,2 М растворов уксусной кислоты и ацетата натрия приготовить несколько мл ацетатного буферного раствора и полоской универсальной индикаторной бумаги измерить его рН.
б) В две пробирки налить по 1-2 мл приготовленного ацетатного буферного раствора. В одну из них добавить каплю 1н. соляной кислоты, в другую - 1н. раствора едкого натра. Определить рН полученных растворов универсальной индикаторной бумажкой и сравнить с исходным значением рН ацетатного буферного раствора (см. опыт 2а). Проделать аналогичный опыт, заменив буферный раствор дистиллированной водой. Объяснить наблюдаемые явления. В чем состоит действие буферных растворов?
в) В стаканчик налить несколько капель приготовленного ацетатного буферного раствора и добавить стократное количество дистиллированной воды. Измерить рН полученного раствора универсальной индикаторной бумажкой. Изменилось ли значение рН по сравнению с исходным (см. опыт 2а).
Опыт 3: Гидролиз солей.
а) Определение характера гидролиза. В пробирки налить по 1-2 мл растворов иодата калия, хлорида аммония, ацетата натрия, хлорида натрия, хлорида магния, хлорида алюминия, сульфата калия и универсальной индикаторной бумажкой определить значения рН. Все ли соли подвергаются гидролизу? Отчего зависит степень гидролиза?
б) Влияние температуры на гидролиз. В пробирку налить 1-2 мл 1н. раствора ацетата натрия и полоской универсальной индикаторной бумаги определить значение рН. Раствор прокипятить и снова измерить рН. Объяснить наблюдаемые явления.
в) Влияние разбавления на гидролиз. В пробирку налить несколько капель концентрированного раствора хлорида сурьмы (III) и добавить по каплям дистиллированную воду до выпадения осадка оксохлорида сурьмы. Написать уравнение гидролиза SbCl3. Затем прибавить несколько капель концентрированной соляной кислоты до растворения осадка. Объяснить наблюдаемые явления.
г) Необратимый гидролиз. В пробирку налить 1-2 мл раствора соли алюминия и прилить равный объем раствора карбоната натрия. Что происходит? Объяснить наблюдаемое явление. Написать уравнение реакции в молекулярной и сокращенно-ионной формах.
Опыт 4: Гетерогенные равновесия.
а) Условия растворения осадков. В пробирку налить 1-2 мл раствора оксалата натрия и прилить равный объем раствора хлорида кальция. Что наблюдается? Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Полученный осадок испытать на растворимость в соляной и уксусной кислотах. Объяснить наблюдаемые явления, пользуясь значениями констант диссоциации соответствующих кислот и произведения растворимости оксалата кальция.
б) Получение одних малорастворимых веществ из других. В пробирке смешать 1-2 мл раствора нитрата свинца с таким же количеством раствора сульфата натрия. Написать уравнение реакции. Осадок отцентрифугировать, добавить к нему 1-2 мл раствора сульфида аммония и хорошо перемешать. Какое вещество образовалось? Пользуясь правилом произведения растворимости, объяснить переход одного осадка в другой.
ВОПРОСЫ САМОКОНТРОЛЯ ПО ТЕМЕ
"ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ".
1. Чем объясняется различная электропроводность водного и спиртового раствора одной и той же соли при равенстве концентраций?
2. Что называется степенью диссоциации? От каких факторов она зависит? Написать математическое выражение закона разбавления Оствальда.
3. От каких факторов зависит степень электролитической диссоциации? Как ее увеличить? Как уменьшить?
4. Почему для характеристики диссоциации сильных электролитов применяют термин "кажущаяся степень диссоциации"?
5. Какой физический смысл имеет изотонический коэффициент Вант-Гоффа? Как связан изотонический коэффициент со степенью диссоциации?
6. Что называется ионным произведением воды и отчего оно зависит?
7. Что такое рН?
8. Как влияют температура и разбавление на гидролиз солей?
9. Почему не все соли гидролизуются? Какие соли не подвергаются гидролизу?
10. Вычислить водородный и гидроксильный показатели (рН и рОН) децинормального раствора азотной кислоты.
11. Вычислить рН 3,12 %-ного раствора соляной кислоты, плотность которого равна 1,015.
12. Вычислить концентрацию ионов водорода и гидроксид-ионов, если рН раствора равен 0,3.
13. Объяснить, почему растворы солей могут иметь: а) кислую; б) щелочную; в) нейтральную реакцию. Привести примеры.
14. Написать молекулярные и сокращенно-ионное уравнения гидролиза солей: а) (NH4)2CO3; б) Na3PO4.
15. Написать уравнения следующих реакций (с учетом возможности необратимого гидролиза образуемых солей):
a) Fe2(SO4)3 + K2CO3 =
б) Al2(SO4)3 + (NH4)2S =
16. Какая из двух солей сильнее гидролизуется: Na2S или Al2S3? Почему?
17. Почему растворы солей NaF и NaClO имеют щелочную реакцию? Написать уравнения гидролиза этих солей.
18. Вычислить значение рН 0,1М раствора СН3СООNа.
19. Что называется буферным раствором? Какими свойствами он обладает?
20. Объяснить, почему рН буферного раствора при добавлении небольших количеств кислоты или щелочи практически не меняется?
21. Как влияет разбавление на буферную емкость раствора?
22. Вычислить рН смеси растворов: а) 0,1н. NH4OH и 1н. NH4Cl; б) 0,1н. NH4OH и 2н. NH4Cl.
23. Что называется произведением растворимости?
24. Что нужно сделать для достижения более полного осаждения Zn2+ в виде ZnS?
25. Что нужно сделать, чтобы растворить осадок Fe(OH)3?
26. Произведение растворимости CaCO3 при некоторой температуре равно 2,25×10-8. Вычислить: а) концентрацию ионов кальция в насыщенном растворе этой соли; б) растворимость карбоната кальция.
27. Растворимость сульфата бария в воде равна 1 : 428000. Вычислить произведение растворимости сульфата бария.
28. Вычислить произведение растворимости Ag2CrO4, если растворимость этой соли равна 0,025 г/л.
29. Вычислить, какие минимальные концентрации растворов CuSO4 и (NH4)2S следует взять, чтобы при смешении их равных объемов выпал осадок СuS.
30. При каком рН начнет осаждаться гидроксид магния из 2н. раствора хлорида? Произведение гидроксида магния равно 5×10-12.
31. Выпадет ли осадок сульфида железа (II) из 0,01н. раствора сульфата железа (II), содержащего 0,1 моль/л соляной кислоты, при пропускании в него сероводорода до насыщения? Концентрация насыщенного раствора сероводорода составляет 0,1 моль/л. Произведение растворимости сульфида железа (II) равно 3×10-9.
32. Сколько процентов цинка будет осаждено в виде сульфида из 0,1М раствора хлорида цинка сероводородом в присутствии формиатной буферной смеси, поддерживающей рН равным двум? Произведение растворимости сульфида цинка равно 1,2×10-23. Концентрация насыщенного раствора сероводорода составляет 0,1 моль/л.
33. Определить, будет ли выпадать осадок хлорида серебра при смешении 10 мл 1×10-6 н. раствора нитрата серебра с 10 мл 1×10-5 н. раствора хлорида натрия.
34. Смешивают 20 мл 0,01н. раствора KCl с 5 мл 0,001н. раствора AgNO3. Определить, выпадает ли в этих условиях осадок AgCl?
ЛАБОРАТОРНАЯ РАБОТА № 4
