Плотность растворов соляной кислоты
| Плотность, г/мл | Массовое содержание, % | Плотность, г/мл | Массовое содержание, % |
| 1,003 | 1,088 | ||
| 1,008 | 1,098 | ||
| 1,018 | 1,108 | ||
| 1,028 | 1,118 | ||
| 1,038 | 1,129 | ||
| 1,048 | 1,139 | ||
| 1,057 | 1,149 | ||
| 1,067 | 1,174 |
4. Если в таблице нет цифры, соответствующей найденной плотности, то последнюю вычисляют методом интерполяции по двум ближайшим величинам.
Например, плотность раствора HСl равна 1,032 г/мл.
Берут значения плотности больше и меньше измеренной, и соответствующие им концентрации. Находят разности:
1,028 – 6%
1,038 – 8%
0,01 – 2%
При увеличении плотности на 0,01 процентное содержание соляной кислоты увеличивается на 2%. Найденная плотность меньше наибольшего значения на 1,038 - 1,032 = 0,006. Находят процентное содержание, соответствующее плотности 0,006:
0,01 – 2%
0,006 - Х%
Х = (2 · 0,006) : 0,01 = 1,2 (%).
Вычитая эту величину из наибольшего значения, получают искомую величину:
8% - 1,2% = 6,8%.
5. Зная процентное содержание HCl, вычисляют объем концентрированного (исходного) раствора, который необходимо взять для приготовления 0,1N раствора HCl. Объем исходного раствора рассчитывают по формуле:
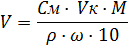
где
V – объем концентрированного (исходного) раствора HCl, мл;
См – молярная концентрация раствора (См = СN ·f), моль/л;
Vк – объем мерной колбы, мл;
М – молекулярная масса вещества, г/моль;
ρ - плотность исходного раствора, г/мл;
ω – процентная концентрация исходного раствора, %.
Например, необходимо приготовить 200 мл 0,1N раствора HCl, тогда

Следовательно, для приготовления 200мл 0,1N (См = 0,1N·1, т.к. f=1) раствора HCl нужно взять 10,4 мл соляной кислоты плотностью 1,032 г/мл.
5. Мерной пипеткой с точностью до десятых долей мл отмеривают рассчитанный исходный концентрированный раствор HCl, переносят в мерную колбу нужного объема и доводят до метки дистиллированной водой так, чтобы нижний край мениска касался метки.


6. Закрывают колбу пробкой и тщательно перемешивают раствор, переворачивая колбу несколько раз. Полученный таким образом раствор является приблизительно 0,1N. Точная нормальность такого раствора устанавливается с помощью титриметрических анализов.
7. Оформляют работу. Формулируют выводы.
Работа 2. Определение нормальности рабочего раствора HCl
По 0,1N раствору NaOH
Задача работы:ознакомление с методикой титриметрического анализа, т.е. определением концентрации рабочего раствора по титрованному раствору.
Оборудование, реактивы: рабочий раствор HCl, титрованный раствор NaOH, фенолфталеин, коническая колба на 250 мл (или иного объема на усмотрение преподавателя), мерные пипетки, бюретка, груша.
Выполнение работы:
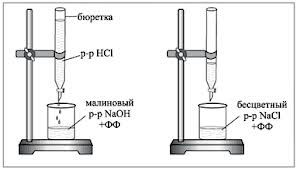 1. Бюретку заполняют исследуемым рабочим раствором HCl. В титровальную колбу отбирают пипеткой 5 мл 0,1N раствора NaOH, добавляют 1-2 капли фенолфталеина и титруют по каплям раствором кислоты до исчезновения малиновой окраски. При титровании содержимое колбы перемешивают вращательными движениями или магнитной мешалкой.
1. Бюретку заполняют исследуемым рабочим раствором HCl. В титровальную колбу отбирают пипеткой 5 мл 0,1N раствора NaOH, добавляют 1-2 капли фенолфталеина и титруют по каплям раствором кислоты до исчезновения малиновой окраски. При титровании содержимое колбы перемешивают вращательными движениями или магнитной мешалкой.
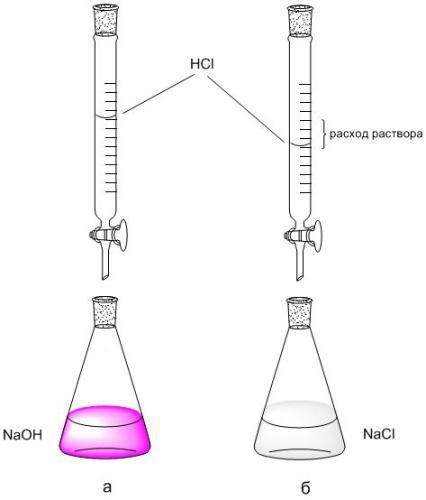 2. По шкале бюретки фиксируют расход раствора HCl (VHCl, мл) пошедший на титрование 5 мл NaOH. Титрование повторяют 2-3 раза, каждое повторное титрование начинают с нулевого отсчета бюретки.
2. По шкале бюретки фиксируют расход раствора HCl (VHCl, мл) пошедший на титрование 5 мл NaOH. Титрование повторяют 2-3 раза, каждое повторное титрование начинают с нулевого отсчета бюретки.
По среднему объему кислоты, пошедшему на титрование щелочи рассчитывают ее нормальность по формуле:

3. Оформляют работу. Формулируют выводы.
Работа 3. Древовидные образования
Задача работы:ознакомление с понятием осмоса и осмотического давления. Изучить сущность явления гемолиза.
 Оборудование, реактивы: штатив с пробирками, раствор силикатного клея, Кристаллы солей: железа, меди, марганца, никеля, кобальта и др. (хлориды, бромиды, нитраты).
Оборудование, реактивы: штатив с пробирками, раствор силикатного клея, Кристаллы солей: железа, меди, марганца, никеля, кобальта и др. (хлориды, бромиды, нитраты).
Выполнение работы:
1. Ряд пробирок наполняют раствором силикатного клея и опускают в пробирки кристаллики солей. Через некоторое время из кристаллов вырастают древовидные образования.
2. Дают объяснение наблюдаемому явлению.
