Закономерности химических реакций
Лабораторная работа №5
Тема: ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИЙ
Все химические реакции сопровождаются поглощением или выделением тепловой энергии. Реакции, идущие с выделением тепла, называются экзотермическими, а с поглощением – эндотермическими. Количество выделенного или поглощенного тепла называется тепловым эффектом реакции.
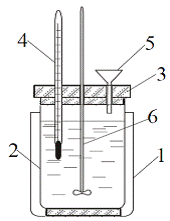
Экспериментальное определение тепловых эффектов химических реакций проводят в специальных устройствах – калориметрах. Калориметр представляет собой сосуд, снабженный теплоизолирующей рубашкой для уменьшения теплообмена с окружающей средой. Простейший калориметр (рисунок 8) состоит из двух стаканов: наружного (1) и внутреннего (2) – собственно калориметра, установленного на теплоизолирующей подставке и снабженного крышкой (3) с отверстиями для термометра (4), воронки (5) и мешалки (6). Чтобы свести потери тепла к минимуму, внутренний стакан не должен касаться стенок внешнего.

Количество теплоты, выделившейся или поглощённой в ходе реакции, определяется по известной формуле:
Q = К·ΔТ, (1)
где К – теплоемкость калориметра, ΔТ – изменение температуры в ходе реакции.
По физическому смыслу теплоемкость калориметра есть количество теплоты, необходимое для нагрева всех его частей на один градус. Она складывается из теплоемкости раствора, который находится во внутреннем стакане (Cp·mp), и теплоемкости самого стакана (Cст·mст):
К = Cp·mp + Cст·mст (2)
Поскольку концентрация раствора мала, удельная теплоемкость раствора принимается равной теплоемкости воды, т.е. 4,18 Дж/(г·К); масса раствора известна и теплоемкость раствора может быть вычисле-на. Однако теплоемкость стакана неизвестна, и её необходимо определить экспериментально. Поэтому данная работа выполняется в два этапа: 1) определение теплоемкости калориметра (опыт 1); 2) определение теплоты реакции (опыты 2–4).
Экспериментальная часть
Целью работы является определение теплового эффекта реакций гашения извести, нейтрализации щёлочи кислотой и взаимодействия алюминия с соляной кислотой.
Опыт 1. Определение теплоемкости калориметра с помощью горячей воды
Ход опыта.
1. Записать температуру калориметра (Т1).
2. С помощью мерного цилиндра набрать в стакан 100 мл воды, нагретой до 50–60 °С, температуру измерить с точностью до десятых долей градуса и записать (Т2). Быстро вылить нагретую воду во внутренний стакан калориметра. Постоянно перемешивая, через каждую минуту замерять температуру воды в калориметре и показания термометра заносить в таблицу:
| Время, мин | |||||||||||
| Т,°С |
В ходе измерений наблюдается три периода: 1) температура в калориметре быстро уменьшается (нагревается внутренний стакан калориметра); 2) температура стабилизируется (наступает тепловое равновесие); 3) температура медленно уменьшается (за счет рассеивания тепла). Для расчетов теплоемкости брать температуру второго периода, остающуюся постоянной в течение 2–3 мин. Эту температуру назовём равновесной и обозначим символом θ (греч. «тэта»).
Количество тепла, сообщенное калориметру нагретой водой, определяется по уравнению
|
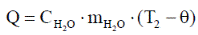
Количество теплоты, поглощенное калориметром, определяется по уравнению:
Q = K·(θ – Т1) (4)
Поскольку левые части уравнений (3) и (4) равны, то приравниваем правые части и получаем формулу для расчета теплоемкости калориметра:
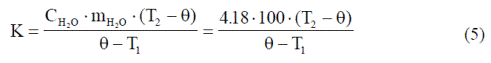
Определяемая по формуле (5) величина К измеряется в Дж/град.
