Вычисления по химическим формулам
Тамбов 2015
Введение
Химия – одна из фундаментальных естественных наук, знание которой необходимо для научно-технической деятельности современного инженера любой специальности. Химия изучает процессы превращения веществ, сопровождающиеся изменением их состава и структуры, а также взаимные переходы между этими процессами и другими формами движения материи: механическая – физическая – химическая – биологическая. Известны две формы существования материи: вещество и поле. Вещество – материальное образование, обладающее при данных условиях определенными свойствами. Поле – материальная среда, в которой осуществляется взаимодействие частиц.
Химия изучает первую форму существования материи – вещество. В современной жизни, особенно в производственной деятельности человека химия играет исключительно важную роль. Нет почти ни одной отрасли производства, не связанной с применением химии. Природа дает нам лишь исходное сырье – дерево, руду, нефть и др. Подвергая природные материалы химической переработке, получают различные вещества – металлы, удобрения, синтетический каучук, пластмассы, искусственное волокно, искусственное топливо, красители, лекарства и т.д. Для химической переработки природного сырья необходимо знать общие законы превращения веществ. И эти знания дает химия. 92% энергии, потребляемой сейчас обществом, мы получаем, осуществляя химические процессы. И если современная энергетика создает экологические проблемы, то виновата в этом не химия, а неграмотное или недобросовестное использование продуктов ее деятельности: химические процессы, продукты, материалы. Наряду с физикой и математикой она составляет основу подготовки специалистов высокой квалификации.
Основные понятия химии
Превращение одних веществ в другие называется химическими рекциями. Внешние признаки химических реакций: 1) выделение теплоты (иногда света); 2) изменение окраски; 3) появление запаха; 4) образование осадка; 5) выделение газа.
Следует отличать физические превращения от химических явлений. Например, горение угля С + О2 = СО2.
Физическими называют такие явления, при которых данные вещества не превращаются в другие, а обычно изменяется только их агрегатное состояние или форма: плавление льда.
Каждое вещество обладает определенным набором химических свойств, которые и определяют его участие в химических реакциях.
От химических свойств следует отличать физические свойства: Важнейшими физическими свойствами веществ являются:
1) агрегатное состояние (твердое, жидкое, газообразное);
2) цвет;
3) плотность;
4) температуры кипения и плавления;
5) тепло- и электропроводность;
6) растворимость в воде и других жидкостях;
7) вкус и запах и т.д.
Химические свойства не зависят от агрегатного состояния, а физические – зависят. Так, сера в любом агрегатном состоянии при сгорании образует SO2, то есть проявляет одно и то же химическое свойство, но ее физические свойства в разных агрегатных состояниях различны. Например, плотность твердой серы 2,1 г/см3, жидкой – 1,8 г/см3, газообразной – 0,004 г/см3.
Молекула - это мельчайшая частица вещества, которая сохраняет его химические свойства. Атомы – это мельчайшие химически неделимые частицы. Каждый отдельный вид атомов называется химическим элементом.
Основные положения атомно-молекулярного учения следующие:
1. Молекулы и атомы находятся в непрерывном и беспорядочном движении.
1827 г., английский ученый Броун увидел в микроскоп движение твердых частиц в жидкости. Частицы движутся непрерывно и беспорядочно. Это явление назвали броуновским движением.
Скорость движения частиц зависит от температуры. С повышением температуры скорость движения молекул возрастает.
2. Между молекулами существуют промежутки, размеры которых зависят от агрегатного состояния и температуры.
Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
При изменении температуры объем тела изменяется. Между молекулами есть промежутки. При нагревании тела промежутки увеличиваются, при охлаждении – уменьшаются.
3. Между молекулами существуют силы взаимного притяжения и отталкивания.
В наибольшей степени эти силы выражены в твердых телах, в наименьшей – в газах.
4. При физических явлениях молекулы сохраняются, при химических – разрушаются. При химических реакциях атомы сохраняются и происходит их перегруппировка.
Все вещества делятся на простые и сложные. Вещества, которые состоят из атомов одного элемента, называются простыми, например сера S, водород Н2, кислород О2, железо Fe. Вещества, которые состоят из атомов разных элементов, называются сложными.Например, вода Н2О, мел CaCO3.
Понятие «простое вещество» нельзя отождествлять с понятием «химический элемент». Простое вещество характеризуется определенной плотностью, растворимостью, температурами кипения и плавления и др. Химический элемент характеризуется определенным положительным зарядом ядра (порядковым номером), степенью окисления, изотопным составом и др. Свойства элемента относятся к его отдельным атомам. Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ водорода и кислорода, а из элементов водорода и кислорода. Названия элементов совпадают с названиями соответствующих им простых веществ, за исключением углерода.
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образовавшиеся вещества аллотропными видоизменениями или модификациями. Явление аллотропии вызывается двумя причинами: 1) различным числом атомов в молекуле, например кислород О2 и озон О3; 2) образованием различных кристаллических форм, например алмаз, графит, карбин, фуллерен (С60 – С70).
Абсолютные массы атомов и молекул очень маленькие величины. Например, масса атома углерода 19,93´10-24 г. Использовать такие числа при расчетах неудобно. Поэтому при расчетах используют относительную величину – относительную атомную массу элемента.
Относительная атомная масса элемента – величина, равная отношению массы атома элемента к 1/12 (одной двенадцатой) массы атома углерода–12.
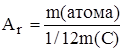
Одна двенадцатая массы атома углерода-12, равная 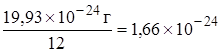 г, называется атомной единицей массы (а.е.м.).
г, называется атомной единицей массы (а.е.м.).
Относительная молекулярная масса вещества – величина, равная отношению массы молекулы вещества к 1/12 массы атома углерода-12.
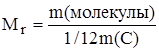
Числовое значение относительной молекулярной массы равно суммe относительных атомных масс атомов, из которых состоит молекула. Например, относительная молекулярная масса воды
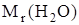 =
= 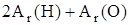 = 2×1,00797+ 1×15,9994 = 18,01534.
= 2×1,00797+ 1×15,9994 = 18,01534.
Задание. Рассчитать относительную молекулярную массу стекла Na2O×CaO×6SiO2.
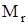 (Na2O×CaO×6SiO2)=
(Na2O×CaO×6SiO2)= 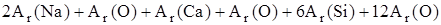 = 2×23+ 16 +40+16+6×28 + 12×16 = 478.
= 2×23+ 16 +40+16+6×28 + 12×16 = 478.
Моль — это количество вещества, содержащее столько частиц (молекул, атомов, ионов или других), сколько содержится атомов в 12 граммах углерода 12С. Количество вещества обозначают n.
Задание. Сколько моль атомов содержится в 1 моле серной кислоты?
n(H) = 2 моль, n(S) = 1 моль, n(O) = 4 моль.
В одном моле вещества содержится 6,02´1023 частиц (молекул, атомов).
1 атом С имеет массу 19,93 × 10-24 г
х частиц имеют массу 12 г
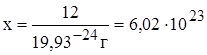
Эта величина называется постоянной Авогадро и обозначается
NA = 6,02´1023 моль-1.
Число частиц рассчитывают по формуле N = n×NA.
Задание.Сколько атомов кислорода содержится в 8-ми молях нитрата кальция Ca(NO3)2?
n(O) = 6×8=48, N(O) = 48 × 6,02×1023 = 289 ×1023 атомов.
Масса одного моля частиц называется его молярной массой (обозначается буквой M).
Молярную массу вещества можно рассчитать по формуле
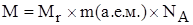 =
= 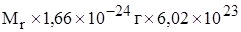 моль-1 =
моль-1 =
= Mr × 1 г/моль
или
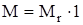 г/моль,
г/моль,
Числовое значение молярной массы вещества М равно относительной молекулярной массе (Mr).
Молярная масса – это величина, равная отношению массы вещества (m) к количеству вещества (n): 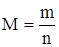
Задача.Рассчитать количество молекул, образующих 100 г углекислого газа, число атомов кислорода, входящие в эту массу, а также массу двух молекул углекислого газа.
Рассчитаем количество вещества n (СО2), соответствующее массе оксида равной 100 г.
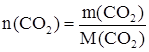 ;
; 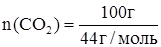 ;
; 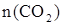 » 2,273 моль.
» 2,273 моль.
Рассчитаем количество молекул, входящих в состав 100 г СО2.
N(CO2) = n(CO2) × NA; N(CO2) = 2,273 × 6,02 ×1023;
N(CO2) = 13,68 × 1023 молекул.
n(O) =2 × 2,273 моль, n(O) =2 × 2,273 моль = 4,546, N(O) = 4,546 × 6,02 ×1023 = 27,367 ×1023;
Рассчитаем массу одной молекулы.
m1(CO2) = n1(CO2)×M = 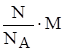 =
= 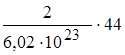 =; m(CO2)=14,6 × 10-23 г.
=; m(CO2)=14,6 × 10-23 г.
Стехиометрические законы
Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные отношения между реагирующими веществами.
1. Закон сохранения массы веществ сформулирован М.В. Ломоносовым (1748 г): Общая масса веществ, которые вступают в химическую реакцию, равна суммарной массе веществ, которые образуются в результате реакции.
Французский химик Лавуазье в 1789 г. подтвердил этот закон и сделал вывод: масса каждого атома, который участвует в реакции, не изменяется в этой реакции, то есть при химических реакциях одни элементы не превращаются в другие.
Однако данный закон справедлив только для изолированной системы. Если же система открытая, то имеет место энергетический эффект (выделение или поглощение теплоты), следовательно, массы исходных веществ и продуктов различаются, что выражается уравнением Эйнштейна:
DE = Dmc2,
где DE – изменение энергии; Dm – изменение массы вещества; c – скорость света в вакууме (3×108 м/с). Масса может переходить в энергию и наоборот. Тем не менее, для химических превращений, в отличие от ядерных, данные эффекты невелики и изменение массы незначительно.
2. Закон постоянства состава.Сформулирован Прустом в 1799 г: Всякое чистое вещество независимо от способа его получения и местонахождения имеет постоянный качественный и количественный состав.
Например, вода может быть продуктом различных химических процессов:
NaOH + HCl ® NaCl + H2O
2H2 +O2 ® 2H2O.
При этом во всех случаях образуются молекулы одной природы, состоящие из двух атомов водорода и одного атома кислорода.
Закон постоянства состава не носит всеобщего характера. По современным представлениям существуют вещества с молекулярным (в основном жидкие и газообразные) и немолекулярным (в основном твердые) строением. Вещества с немолекулярной структурой состоят из атомов или ионов и называются макротелами. Кроме того, наряду с соединениями постоянного состава (дальтониды), существуют соединения переменного состава (бертоллиды). В связи с этим в современную формулировку закона вносят уточнение: Состав соединений молекулярной структуры является постоянным независимо от способов получения, состав соединений с немолекулярной структурой зависит от условий получения.
3. Закон объемных отношенийсформулирован в 1808 г. Гей-Люссаком: Объемы газообразных веществ, вступающих в реакцию, и объемы газообразных продуктов реакции при одинаковых условиях (давление, температура) относятся между собой как простые целые числа.
Например, при взаимодействии азота и водорода с образованием аммиака протекает реакция
N2 + 3H2 = 2NH3.
V (N2) :V (H2) V (NH3) = 1 : 3 : 2.
4. Закон Авогадро сформулирован в 1811 г.: В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Экспериментально было установлено, что молекулы простых газов (водорода, кислорода, азота, фтора, хлора и др.) состоят из двух атомов. Наиболее простой пример: в результате реакции водорода с хлором образуется 2 объема хлороводорода, а не один.
H2 + Cl2 = 2HCl
Следствия из закона Авогадро:
1) Один моль любого газа при одинаковых условиях занимает один и тот же объем.
При нормальных условиях (н. у.) (t = 0°С и Р=101325 Па) 6,02×1023 молекул (1 моль) любого газа занимают объем, равный 22.4 л. Этот объем называется молярным объемом газа Vm.
Vm = V/n, V = nVm,
Vm = M/ 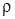
Vm измеряется в л/моль; r – плотность измеряется в г/л.
Задание.Определить Mr газа, если при н.у. его плотность равна 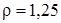 г/л.
г/л.
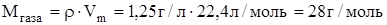
Mr= 28
Задание. Определить молярную массу газа, если 4,2 г газа занимают при н. у. объем 3 л.
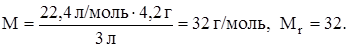
2) Массы равных объемов различных газов при одинаковых условиях относятся как относительные молекулярные (или молярные) массы этих газов. Отношение масс газов, находящихся в равных объемах при одинаковых условиях, называется относительной плотностью одного газа по другому D.
D = m1/m2 или D = M1/M2
Задание. Определить относительную плотность сероводорода по воздуху.
Относительная молекулярная масса воздуха 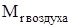 = 29, поэтому относительную плотность газа по воздуху рассчитывают по формуле
= 29, поэтому относительную плотность газа по воздуху рассчитывают по формуле
D = M(H2S)/M(воздуха)
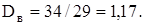
Относительная плотность показывает, во сколько раз один газ тяжелей другого.
Уравнение состояния газов.
Для каждой однородной системы справедливо соответствующее уравнение состояния, которое связывает между собой ее объем, давление и температуру. Для идеальных газов, для которых расстояние между образующими их частицами (молекулы, атомы) гораздо больше размеров самих частиц и можно пренебречь взаимодействием между ними в виду его малости, такое уравнение имеет вид
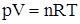
Это уравнение называется уравнение Менделеева – Клапейрона. Отметим, что Р – давление, создаваемое газом или суммарное давление всех компонентов газовой смеси, V – объем, Т - температура по шкале Кельвина
(0°С=273 К) и R – универсальная газовая постоянная, равная в Международной системе единиц 8,31 Дж/(моль×К).
Ели давление измеряется в Па, то объем – в м3, или, соответственно, давление в кПа, а объем – в л.
1 л = 10–3 м3; 1 кПа = 103 Па.
Задание.Газ массой 30,3 г заполнил сосуд вместимостью 15 л при температуре 180С. Давление газа внутри сосуда составляет 12200 Па. Рассчитайте молярную массу газа.
М = 
5. Закон эквивалентов.Эквивалентом элемента называют такое его количество, которое соединяется с одним моль атомов водорода или замещает то же количество атомов водорода в химических соединениях.
Э(элемента) = 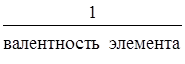 , моль-экв. (Валентность – это число химических связей, образуемых данным атомом).
, моль-экв. (Валентность – это число химических связей, образуемых данным атомом).
Всегда Э(Н) = 1 моль-экв, Э(О) = ½ моль-экв.
Масса одного эквивалента элемента называется его эквивалентной массой.
МЭ (элемента) = М(элемента)×Э(элемента), г/моль-экв.
Всегда МЭ(Н) = 1 г/моль-экв, МЭ(О) = 8 г/моль-экв,
Задание.Определить эквивалент и эквивалентную массу азота в NH3 и углерода в метане CH4.
Э(N) = 1/3 моль-экв, МЭ (N) = 14/3 = 4,67 г/моль-экв;
Э (С) = 1/4 моль-экв, МЭ (С) = 12/4 = 3 г/моль-экв.
Задание.Определите эквивалентную массу азота в оксиде N2O.
МЭ (N) = 14/1 = 14 г/моль-экв
Эквивалент оксида равен:
Э(оксида) = 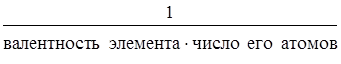 .
.
МЭ (оксида) = М(оксида)×Э(оксида).
Задание. Определить эквивалентную массу оксида азота NО2.
МЭ (NО2)= 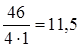 г/моль-экв.
г/моль-экв.
Эквивалент кислоты равен:
Э (кислоты)= 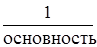 . Основность – это число атомов водорода в молекуле кислоты.
. Основность – это число атомов водорода в молекуле кислоты.
МЭ (кислоты) = М(кислоты)×Э(кислоты).
Задание.Определить эквивалентную массу угольной кислоты Н2СО3.
МЭ (Н2СО3)= 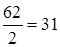 г/моль-экв.
г/моль-экв.
Эквивалент основания равен:
Э(основания) = 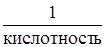 . Кислотность – это число гидроксогрупп в молекуле основания.
. Кислотность – это число гидроксогрупп в молекуле основания.
МЭ (основания) = М(основания)×Э(основания).
Задание.Определить эквивалентную массу гидроксида алюминия Al(OH)3.
МЭ (Al(OH)3)= 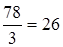 г/моль-экв.
г/моль-экв.
Эквивалент соли равен:
Э(соли) = 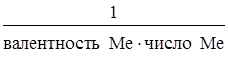 .
.
МЭ (соли) = М(соли)×Э(соли).
Задание.Определить эквивалентную массу сульфата железа (III) Fe2(SO4)3.
МЭ (Fe2(SO4)3)= 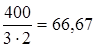 г/моль-экв.
г/моль-экв.
Рихтер сформулировал закон: Массы веществ, которые вступают в реакцию и образуются в результате реакции, пропорциональны их эквивалентам или эквивалентным массам.
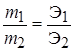 или
или 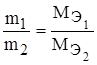 .
.
Задание.При соединении 1,50 г натрия с хлором образовалось 3,81 г хлорида натрия. Найти эквивалентную массу натрия, если эквивалентная масса хлора 35,45 г/моль-экв.
m(Cl) = m(NaCl) – m(Na) = 3,81 – 1,50 = 2,31 г.
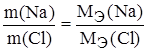 ,
, 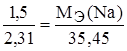 ,
, 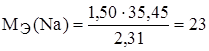 г/моль-экв.
г/моль-экв.
Задание. Рассчитайте эквивалентную массу и валентность железа, если 22,4 г железа соединяются с 9,6 г кислорода.
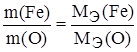 ;
; 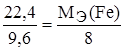 , МЭ(О) = 16/2=8 г/моль-экв.
, МЭ(О) = 16/2=8 г/моль-экв.
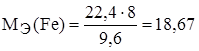 г/моль-экв.
г/моль-экв.
МЭ (Fe) = М (Fe)×Э(Fe), Э(Fe) = 1/валентность, МЭ (Fe) = 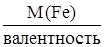 ,
,
Валентность = 56/18,67 = 3.
И УРАВНЕНИЯМ
Строение атома
В XIX в. считали, что атом – неделимая частица, которая не изменяется при химических реакциях. В концеХIХ- начале XX вв. были открыты рентгеновское излучение (немецким ученым К. Рентгеном, 1895 г), радиоактивность (французским ученым А. Беккерелем, 1896), электрон (английским ученым Дж. Томсоном, 1897 г.). Масса m(е)=9,109×10–28г и отрицательный заряд q(e)=1,602×10–19Кл. Величина заряда электрона принята за единицу элементарного электрического заряда.
В 1903 г. Дж. Томсон предложил модель строения атома, согласно которой положительный заряд равномерно распределен по объему атома и нейтрализован вкрапленными в него электронами. Развивая эти представления, Э. Резерфорд в 1911г. предложил планетарную модель строения атома. По этой теории в центре атома находится положительно заряженное ядро, вокруг которого движутся электроны. Совокупность электронов в атоме называется его электронной оболочкой. В 1913 г. Английский ученый Д. Мозли обнаружил, что величина положительного заряда ядра атома равна порядковому номеру элемента в периодической системе элементов Д. И. Менделеева. Атом электронейтрален, следовательно, число электронов в электронной оболочке атома равно заряду ядра Z или порядковому номеру элемента в периодической системе.
В 1932 г. советские ученые Д. Д. Иваненко и Е. Н. Гапон и, независимо от ниx, немецкий ученый В. Гейзенберг создали протонно-нейтронную теорию строения ядра. Протон р - это частица с массой, равной 1 а. е. м.
(1,66 ×10–24 г), и зарядом + 1. Нейтрон n – это электронейтральная частица массой, близкой к массе протона. Протоны и нейтроны называют нуклонами.
Заряд ядра атома определяется числом протонов. Следовательно, число протонов в ядре атома также равно порядковому номеру элемента в периодической системе. Общее число протонов и нейтронов называется массовым числом (А). Оно равно округленному до целого числа значению относительной атомной массы.
Ar = р + n,
Задание. Какой заряд ядра и сколько электронов, протонов, нейтронов в атоме цинка?
Z=+30, p=30, e=30, n = 65–30 = 35.
Изотопы
Разновидности атомов одного элемента, обладающие одинаковыми зарядами ядер, но разными массовыми числами (одинаковым числом протонов и разным числом нейтронов), называются изотопами. Химические свойства всех изотопов одного элемента одинаковы.
Каждый изотоп характеризуется двумя величинами: массовым числом (проставляется вверху слева от химического знака) и порядковым номером (проставляется внизу слева от химического знака) и обозначается символом соответствующего элемента. Например, элемент водород имеет три изотопа.  Н – протий (1 р);
Н – протий (1 р);  D (
D ( 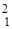 Н) - дейтерий (1р, 1 n);
Н) - дейтерий (1р, 1 n); 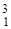 T (
T ( 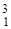 Н) - тритий (1 р, 2 n).
Н) - тритий (1 р, 2 n).
Задание.Сколько протонов и нейтронов содержат ядра изотопов 36Ar, 38 Ar, 40Ar?
36–18 = 18; 38 – 18 = 20; 40 – 18 = 22.
Относительная атомная масса элемента в периодической системе элементов Д. И. Менделеева - это среднее арифметическое масс атомов его изотопов с учетом их распространенности в природе.

Например, природный хлор - это смесь 77,4% изотопа 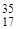 С1 и 22,6% изотопа
С1 и 22,6% изотопа 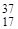 Сl. Поэтому
Сl. Поэтому
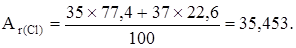
Задание. Медь состоит из изотопов  Cu и
Cu и  . Сколько процентов каждого изотопа содержится в меди, если
. Сколько процентов каждого изотопа содержится в меди, если 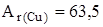 46?
46?
w( 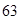 Cu)=х%, w(
Cu)=х%, w(  Cu)=(100–х)%,
Cu)=(100–х)%,

6354,6=63х+6400–64х
х=6400–6354,6, х = 45,4; w( 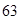 Cu)= 45,4%.
Cu)= 45,4%.
w(  Cu)=100–45,4=54,6%,
Cu)=100–45,4=54,6%,
В атоме не может быть двух электронов с одинаковым значением всех четырех квантовых чисел. На одной орбитали может находиться не более двух электронов и эти электроны имеют противоположные (антипараллельные) спины.


 Орбиталь с двумя электронами, спины которых антипараллельны (квантовая ячейка), схематически изображают так:
Орбиталь с двумя электронами, спины которых антипараллельны (квантовая ячейка), схематически изображают так:
Максимальное число электронов (N) в электронном слое можно определитьпоформуле N = 2n2, п - номер слоя (главноеквантовое число).
1) n = 1, N = 2×12 = 2
 n = 1
n = 1
s
Электронная конфигурация 1s2: большая цифра показывает номер слоя (главное квантовое число); буква(s, p, d, f) обозначает форму орбитали (орбитальное квантовое число); маленькая цифранадбуквой справавверхупоказывает число электронов наданнойорбитали.
2) n = 2, N = 2×22 = 8
 |
n = 2
s р
2s22p6
3) n = 3, N = 2×32 = 18
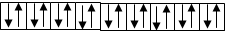 |
n = 3
s p d
3s23p63d10
4) n = 4, N = 2×42 = 32
 |
n = 4
s p d f
4s24p64d104f14
Правило наименьшего запаса энергии:
Орбитали заполняются электронами в порядке возрастания их энергии, которая характеризуется суммой n + l. При этом если сумма
п + l двух разных орбиталей одинакова, то раньше заполняется орбиталь, у которой n меньше.
Как видно из таблицы, порядок заполнения электронных орбиталей по сумме п + 1 следующий:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f146d107p66f147d107f14.
| n | l | n+l | Орбиталь | Порядок заполнения | n | l | n+l | Орбиталь | Порядок заполнения |
| 1+0=1 | 1s2 | 5+0=5 5+1=6 5+2=7 5+3=8 | 5s2 5p6 5d10 5f14 | ||||||
| 2+0=2 2+1=3 | 2s2 2p6 | 6+0=6 6+1=7 6+2=8 6+3=9 | 6s2 6p6 6d10 6f14 | ||||||
| 3+0=3 3+1=4 3+2=5 | 3s2 3p6 3d10 | 7+0=7 7+1=8 7+2=9 7+3=10 | 7s2 7p6 7d10 7f14 | ||||||
| 4+0=4 4+1=5 4+2=6 4+3=7 | 4s2 4p6 4d10 4f14 |
Правило Гунда (правило наибольшего суммарного спинового числа):
Свойства химических элементов, а также формы и свойства их соединений, находятся в периодической зависимости от величины заряда их атомных ядер или порядкового номера элемента в периодической системе.
Химическая связь
Химическая связь – это вид межатомных взаимодействий в молекулах, ионах, кристаллах, характеризуемый определенной энергией. При всем многообразии химических связей их природа едина и носит электростатический характер.
Валентные электроны – электроны предвнешнего и внешнего электронных слоев, участвующие в образовании химической связи. Валентность – это свойство атомов элемента образовывать химическую связь, она определяется числом этих связей.
Ковалентная связь
Ковалентная связь образуется за счет общих электронных пар, возникающих на внешних и предвнешних подуровнях связываемых атомов.
Ковалентная связь бывает двух типов: неполярная и полярная.
Неполярная связь возникает между атомами неметалла одного химического элемента, т.е. атомами с одинаковой электроотрицательностью (O2, N2, Cl2).
Рассмотрим образование молекулы водорода Н2. Электронная конфигурация атома водорода 1s1, т. е. на внешнем электронном слое (он единственный) находится один неспаренный электрон. При образовании молекулы водорода из двух атомов, имеющих непарные s-электроны с антипараллельными спинами, происходит перекрывание s-орбиталей и образуется общая электронная пара (рис. 4а).

Рис. 4. Перекрывание: а - s-орбиталей; б- s- и р-орбиталей;
в - р-орбиталей.
 |
Схематически это можно изобразить с помощью электронных формул:
Н··+ ·Н ® Н : Н
Если общие электронные пары обозначать чертой, то электронная формула превращается в структурную:
Н–Н
Общая электронная пара одинаково принадлежит обоим атомам, каждый атом получает устойчивую оболочку из двух электронов. Наибольшая электронная плотность общего электронного облака проявляется в области между ядрами. Молекула водорода образуется за счет взаимодействия общей электронной пары с ядрами обоих атомов.
Задание. Изобразить схему образования молекулы хлороводорода.
Cl 1s22s22p63s23p5; Н 1s1
Общая электронная пара смещается к атому с большей электроотрицательностью. ЭО (Cl) = 2,83 эВ, ЭО(Н) = 2,1 эВ.
Н··+ · 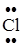 : ®
: ® 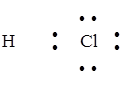
H–Cl
Электронная пара смещена к атому хлора, т.к. ЭО(Cl) > ЭО(Н).
Гибридизация
Гибридизация – выравнивание орбиталей по форме и энергии.
Sp-гибридизация
Рассмотрим на примере гидрида бериллия ВеН2. Электронное строение атома Ве в нормальном состоянии 1s22s2. Атом бериллия может вступать во взаимодействие с атомами водородом только в возбужденном состоянии (s ® р-переход).
Ве – 1s22s12p1
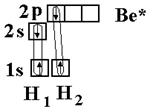
Две образующиеся связи должны быть различны по энергии, так как возникновение одной связано с перекрыванием двух s-орбиталей, вто-
рой – s- и p-орбиталей. Тогда и атомы водорода в молекуле должны быть химически неравноценны: один более подвижен и реакционноспособен, чем другой. Экспериментально это не так – оба атома водорода энергетически равноценны. Для объяснения этого явления Дж.К. Слейтер и Л. Полинг предположили, что «при интерпретации и расчете углов между связями и длины связи целесообразно близкие по энергии связи заменить равным количеством энергетически равноценных связей». Возникающие подобным образом связи являются гибридными.
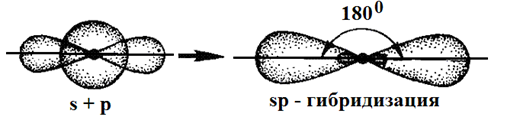
Таким образом, одна s- и одна р-орбиталь атома бериллия заменяются двумя энергетически равноценными sp-орбиталями, располагающимися под углом 180о друг к друг, т.е. молекула имеет линейное строение.
sp2-гибридизация
Рассмотрим на примере молекулы гидрида бора ВН3. Электронное строение атома бора в нормальном состоянии следующее В – 1s22s22p1. Он может образовать только одну ковалентную связь. Три же ковалентные связи для атома бора характерны только в возбужденном состоянии В* – 1s22s12p2
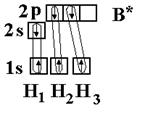
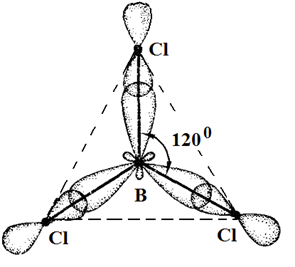
Одна связь, образованная при перекрывании двух s-орбиталей атомов В и Н, энергетически не отличается от двух других, образуемых перекрыванием s- и р-орбиталей. Три sp2-гибридные орбитали расположенные под углом 120о друг к другу, молекула имеет плоское строение. Подобная картина характерна для любых четырехатомных молекул, образованных за счет трех sp2-гибридных связей, например, для хлорида бора (BCl3).
sp3-гибридизация
Рассмотрим на примере метана СН4. В нормальном состоянии атом углерода с электронным строением 1s22s22p2 может дать только две ковалентные связи. В возбужденном состоянии он способен быть четырехвалентным с электронным строением 1s22s12р3.
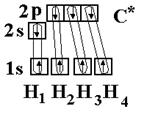
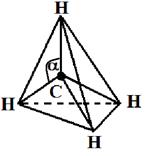
Гибридными становятся одна s- и три р-орбитали атома углерода, при этом образуются четыре sp3-гибридные, энергетически равноценные орбитали. Молекула метана приобретает тетраэдрическое строение. В центре тетраэдра, все вершины которого геометрически равноценны, находится атом углерода, а в его вершинах атомы водорода. Угол между связями составляет 109о28¢.
Силы взаимодействия между молекулами называют ван-дер-ваальсовыми или межмолекулярными. Это взаимодействие обусловлено электростатическим притяжением между отдельными молекулами и характеризуется следующими особенностями:
- действует на сравнительно больших расстояниях, существенно превосходящих размеры самих молекул;
- характеризуется малой энергией, поэтому существенно ослабевает с повышением температуры;
- является ненасыщающимся, т. е. взаимодействие данной молекулы со второй не исключает подобного эффекта по отношению к третьей, четвертой и т. д.
С ростом относительных молярных масс силы межмолекулярного взаимодействия возрастают и, как следствие, повышаются температуры плавления и кипения веществ.
Ионная связь
Принято считать связь ионной, если разница электроотрицательностей атомов ΔЭО > 1,9.
Задание. Вычислить разность электроотрицательностей атомов ΔЭО для связей O–H и О–Мg в соединении Мg(ОН)2 и определить какая из этих связей более полярна. ЭО(Н) = 2,1 эВ, ЭО(О) = 3,5 эВ, ЭО(Mg) = 1,2 эВ.
Решение:
ΔЭО(O–H) = 3,5 – 2,1 = 1,4; ΔЭО(O–Mg) = 3,5 – 1,2 = 2,3.
Таким образом, связь Mg–О более полярна.
При образовании соединений из элементов, очень отличающихся по электроотрицательности (типичных металлов и типичных неметаллов), общие электронные пары полностью смещаются к более электроотрицательному атому. Например, при горении натрия в хлоре неспаренный 3s-электрон атома натрия спаривается с 3p-электроном атома хлора. Общая электронная пара полностью смещается к атому хлора (Δχ(Cl) = 2,83 эВ, Δχ(Cl) = 0,93 эВ). Чтобы ионная связь возникла необходимо:
1. Наличие атома с четко выраженной тенденцией к отдаче электрона с образованием положительно заряженного иона (катиона), т.е. с малой ЭИ. Потенциал ионизации – энергия, которую необходимо затратить для удаления 1-го электрона с внешней орбитали. Чем меньше потенциал ионизации, тем легче атом теряет электроны, тем сильнее выражены у элемента металлические свойства. Потенциал ионизации растет в пределах периода слева направо, уменьшается сверху вниз.
Процесс отдачи электронов называется окислением.
Na –e ® Na+
2. Наличие атома с четко выраженной тенденцией к присоединению электрона с образованием отрицательно заряженных ионов (анионов), т.е. с большим СЭ. Процесс присоединения электронов называется восстановлением.
Cl + e ® Cl–
Типичные ионные соединения образуются при соединении атомов металлов главных подгрупп I и II групп с атомами неметаллов главной подгруппы VII группы (NaCl, KF, СаС12).
Между ионной и ковалентной связью нет резкой границы. В газовой фазе вещества характеризуются чисто ковалентной полярной связью, но эти же вещества в твердом состоянии характеризуются ионной связью.
Характеристики ионной связи
1. Направленность в пространстве. Каждый ион представляет собой как бы заряженный шар, который может притягивать ионы противоположного знака по любому напрвлению.
2. Ненасыщаемость – взаимодействие ионов противоположного знака не приводит к компенсации силовых полей. Способность притягивать ионы противоположного знака у них остается и по другим направлениям. Взаимодействие с ними будет энергетически ра
