Энтропия и свободная энергия системы.
НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ ПРОЦЕССОВ.
Вопрос о самопроизвольном протекании реакции решается расчетным путем на основании уравнения: ΔG=ΔH-T*ΔS где: ΔG-изменение свободной энергии Гиббса кДж/моль; ΔН-изменение энтальпии, кДж/моль; ΔS-изменение энтропии Дж/моль*К; Т-абсолютная температура, К.
О направлении химических реакций позволяет судить знак ΔG:
ΔG<0 ( в химическом процессе происходит понижение свободной энергии Гиббса)-процесс может идти самопроизвольно.
ΔG>0-процесс невозможен.
ΔG=0-в системе устанавливается равновесие.
Мерой неупорядоченности в системе является энтропия, вычисляемая по формуле: S=K*lnW , где К-постоянная Больцмана; W-термодинамическая вероятность. Это число равновероятных микросостояний, которыми может быть реализовано данное макросостояние. Энтропия увеличивается с ростом беспорядка в системе.
ОБЪЕКТ ИССЛЕДОВАНИЯ.
Определение теплового эффекта реакции.
5. КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. В чем, по вашему мнению, может быть причина расхождений между результатами ваших измерений и расчетов?
2. При каких химических реакциях измеренная энтальпия реакции равна энергии этой реакции?
3.Вычислить стандартную энтальпию образования сероуглерода, по реакции сгорания 38г. сероуглерода: CS2+3O2=2SO2+CO2 ΔH= - 1103 кДж?
4.Какие термодинамические функции вы знаете ?
ОПИСАНИЕ ЛАБОРАТОРНОЙ УСТАНОВКИ И ПОРЯДОК ПРОВЕДЕНИЯ ОПЫТА.
Оборудование и реактивы: термометр ртутный, калориметр, цилиндр на 100мл, сухие вещества NH4CNS, KOH, KCl, NH4Cl.
ОПЫТ 1: Определение теплоты растворения.
Для определения изменений энтальпии используется так называемый открытый калориметр, состоящий из внутреннего калориметрического стакана и стакана, играющего роль внешней оболочки, а также теплоизоляционной прослойки между ними, крышки, термометра (рис. 1)
Калориметрический стакан наполняют 250 мл дистиллированной воды, закрывают крышкой и в течение 15 минут следят по термометру за температурой, делая замеры через каждые 3 минуты по секундомеру. Затем вносят указанное количество растворяемого вещества (Н2SO4 из пипетки, соль или щелочи высыпают в твердом состоянии). Момент внесения вещества отмечают как 0 секунд главного периода, жидкость размешивают до полного растворения вещества - конец главного периода, отмечают температуру калориметрической жидкости, затем в течение 18 минут следят за изменением температуры, отмечая её через каждые 3 минуты по секундомеру. Результаты опыта заносят в таблицу 1:
Таблица №1.
| Предварительный период (15 мин.) | Главный период | Заключительный период (18 мин.) | |
| 0, мин. | 0 3 6 9 12 15 | n (сек.) | 0 3 6 9 12 15 18 |
| Т,˚С |
Т - определяют графическим способом (рис. 2).
Расчет результатов опыта:
1. Количество теплоты:
Q=ΔT*(mк.ж.*4,18+Cк), где
Т-изменение температуры.
4,18Дж/г*град - удельная теплоемкость воды;
mк.ж - масса калориметрической жидкости;
mк.ж= mH2O+mв-ва
mH2O- масса воды в граммах;
mв-ва- масса растворенного вещества в граммах;
Ск- теплоемкость калориметра;
Ск=146,3 Дж/град;
2. Тепловой эффект реакции ΔH:
ΔH=Q/V, где
V- количество моль реагирующего вещества (V=m(растворим. в-ва)/М)
РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ПРОВЕДЕНИЮ ЭКСПЕРИМЕНТА.
1. График построить на миллиметровой бумаге.
2. Причиной высокого значения относительной ошибки результатов опыта является несовершенство упрощенного калориметра.
СОСТАВЛЕНИЕ ОТЧЕТА.
1.Цель работы, задание
2. Порядок проведения опыт
3. Задание.
4. Таблица экспериментальных данных.
5. Рисунок калориметра (рис.1)
6. График с определением ΔТ на миллиметровой бумаге, размером 15на15 см включить в отчет (рис.2).
7. Описание опыта.
8. .Расчет ΔН и относительной погрешности η в %.
9. Вывод
10. Ответы на контрольные вопросы.
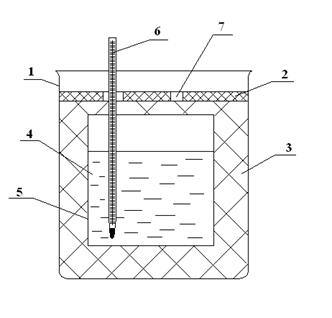
Рис. 1 Калориметр.
1. Внешний стакан
2. Крышка
3. Теплоизоляционная прокладка
4. Калориметрическая жидкость
5. Внутренний калориметрический стакан
6. Термометр
7. Отверстия для внесения испытуемых веществ
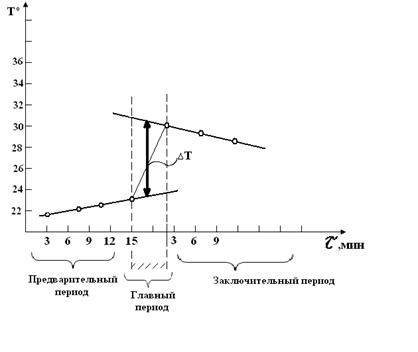
рис. 2
Графическое определение ΔТ.
СПИСОК ЛИТЕРАТУРЫ.
1..Глинка Н.Л. Задачи и упражнения по общей химии . Москва: Интеграл –
пресс, 2001 – 2006,66 -79 с.
2. Коровин Н. В. Общая химия. – М.: Высшая школа, 2004,116 -141 с.
3.Белозерова Т.И. Химия. Конспект лекций. в двух частях для. инженерно- технических ( нехимических) специальностей.- Северодвинск: Севмашвтуз., 2009г.,часть1.
4. Белозерова Т.И. Термохимические расчеты. Химическое равновесие. Правило Ле Шателье. Методические указания к практическим работам. Севмашвтуз, 2006,
14с.
РЕКОМЕНДАЦИИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ.
1. Соблюдайте осторожность при работе с термометром и с раствором щелочи.
2 В случае попадания щелочи на одежду следует смыть её водой, а затем нейтрализовать раствором уксусной кислоты с массовой долей 5%.
3.При попадании на лицо, глаза и на руки химических реактивов следует промыть пораженный участок большим количеством воды.
4.Не оставляйте на рабочих местах грязную посуду.
Лабораторная работа № 2.
