Электроны от перешли к ионам восстановили их в свободный металл и в растворе остались ионы железа.
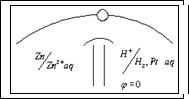
Однако, опыт можно усложнить. Разделим эти процессы. Пусть электроны от Zn потекут к ионам  по металлическому проводнику. Для этого в один стакан нальем раствор сульфата меди и опустим туда медную пластинку, а в другой стакан нальем раствор сульфата цинка и опустим цинковую пластинку, соединим обе пластины проводником, а оба - сосуда электролитическим ключом (трубка с раствором соли), чтобы замкнуть цепь. Теперь по отклонению стрелки гальванометра можем судить, что по цепи перемещаются заряды, т.е. идёт ток.
по металлическому проводнику. Для этого в один стакан нальем раствор сульфата меди и опустим туда медную пластинку, а в другой стакан нальем раствор сульфата цинка и опустим цинковую пластинку, соединим обе пластины проводником, а оба - сосуда электролитическим ключом (трубка с раствором соли), чтобы замкнуть цепь. Теперь по отклонению стрелки гальванометра можем судить, что по цепи перемещаются заряды, т.е. идёт ток.
Это наиболее простой гальванический элемент Якоби - Даниэля.
Появление электрического тока объясняют возникновением скачка потенциала
на границе раздела металл – электролит.
.В растворе соли опустим пластинку металлическую, имеющую одноимённые ионы в растворе.
Возьмём для примера Zn
 Zn
Zn
 aq
aq
Свободная энергия ионов Zn в металле больше, чем свободная энергия ионов в Zn в растворе, поэтому ионы цинка (  ) из металла будут переходить в раствор. Оставшиеся электроны ни заряжают поверхность пластинки отрицательно, а раствор за счёт ионов цинка заряжаются положительно. Возникает двойной электрический слой, в котором заряды распределены, как в плоскости конденсатора (рис.4.1).
) из металла будут переходить в раствор. Оставшиеся электроны ни заряжают поверхность пластинки отрицательно, а раствор за счёт ионов цинка заряжаются положительно. Возникает двойной электрический слой, в котором заряды распределены, как в плоскости конденсатора (рис.4.1).
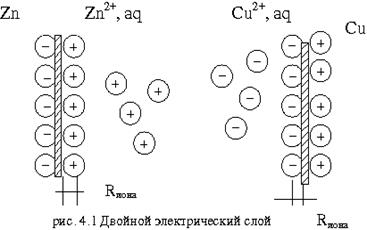
Опустим в раствор медную пластинку. Свободная энергия ионов Cu в растворе больше, чем в металле. Следовательно, ионы меди из раствора переходят на металл, заряжая поверхность металла положительно, а оставшиеся ионы в растворе, прилегающую поверхность электролита заряжают отрицательно (рис.4.1). Когда металл заряжен положительно – этот заряд, препятствует дальнейшему переходу ионов из растворов на металл. Устанавливается электрохимическое равновесие, – образуется двойной электрический слой.
Это приводит к возникновению разности потенциалов на границе металл – электролит.
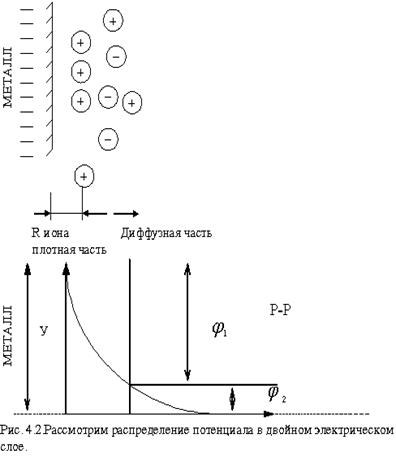
Рассмотрим распределение катионов в двойном электрическом слое.
Часть ионов остаётся на поверхности электрода, образуя плотную часть двойного электрического слоя. Толщина плотной части двойного электрического слоя приблизительно равна радиусу ионов, составляющих слой. Диффузный слой - его толщина при данной температуре определяется зарядом и концентрацией ионов, входящих в диффузную часть двойного слоя.
Внутри плотной части двойного слоя электрических зарядов нет, поэтому изменение заряда здесь линейное. В диффузной части потенциал изменяется по экспоненциальному закону (рис.4.2).
Вывод: при погружении металла в раствор, образуется электрический слой и возникает разность потенциалов между металлом и раствором.
Потенциал - это энергия для переноса электрического заряда, из какой- то данной точки в бесконечность.
Практически определить потенциал одного двойного слоя не возможно. Его можно определить, если соединить проводниками два двойных слоя. Так как процессы равновесные, то значение потенциала мы будем называть равновесным электродным потенциалом. Если металл опустить в раствор его соли, содержащий 1моль-ион металла в литре, то электродный потенциал будет постоянной величиной. Такой потенциал называется нормальным или стандартным электродным потенциалом.
Относительную величину равновесного электродного потенциала измеряют по отношению к стандартному водородному электроду, потенциал которого условно принимают равным нулю.
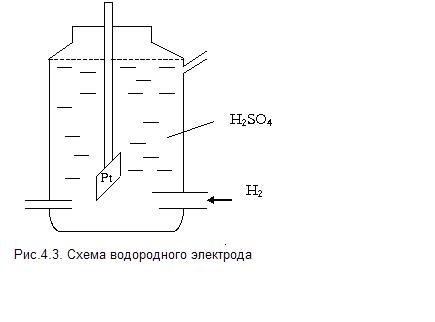
Он состоит из платиновой пластинки, покрытой платиновой чернью. Электрод погружаем в 2 н раствор серной кислоты ( 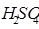 ) и обмываем струёй газообразного водорода при Р=
) и обмываем струёй газообразного водорода при Р= 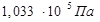 (рис.4.3).
(рис.4.3).
На границе электрода с раствором кислоты устанавливается равновесие 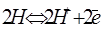 , а на поверхности платины
, а на поверхности платины 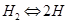 Суммарная реакция выразится уравнением
Суммарная реакция выразится уравнением 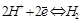
Схематически водородный электрод обозначают:
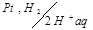
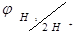
Чтобы определить потенциал другого слоя соединяют стандартный водородный электрод с другим двойным слоем. Принято отрицательный электрод писать слева двойная черта - условный раздел электролитов.

|
|

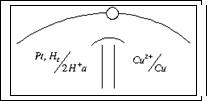
A: 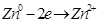 A:
A: 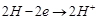
K: 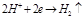 K:
K: 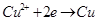
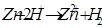 - т. обр.
- т. обр. 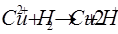 - т. обр. реакция
- т. обр. реакция
 φ Zn φ= +0,34B
φ Zn φ= +0,34B
Zn2+=-0,76B
Значение стандартных равновесных потенциалов найдены при условиях 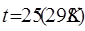 ;
; 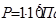 . Значения их сведены в таблицу.
. Значения их сведены в таблицу.
Выводы по таблице «Стандартные потенциалы металлов».
Сравнивая значения равновесных потенциалов металлов можно сделать вывод:
1. Сильные восстановители имеют более отрицательное значение (самый сильный восстановитель 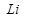 , самый слабый
, самый слабый 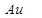 )
)
2. Окислительные свойства ионов усиливаются от 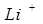 к
к 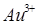 Самый сильный окислитель
Самый сильный окислитель 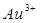 ,а самый слабый
,а самый слабый 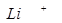 .
.
3. Все металлы стоящие до водорода способны выделять 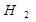 из разбавленных кислот, кроме
из разбавленных кислот, кроме 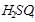 - концентрированной и
- концентрированной и 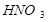 , любой концентрации.4. Каждый впереди стоящий металл вытесняет последующий из растворов.
, любой концентрации.4. Каждый впереди стоящий металл вытесняет последующий из растворов.
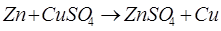
5. Чем дальше в ряду активности находятся друг от друга металлы, тем больше значение разности потенциалов в гальваническом элементе, уставленных из них.
