Неокислительное дезамитровате
В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот серина, треонина и гистидина неокислительным путём.
Неокислительное дезаминирование серинакатализирует сериндегидратаза (см. схему А на с. 477).
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
Неокислительное дезаминирование треонина катализирует фермент треониндегидратаза. Механизм реакции аналогичен дезаминированию серина (см. схему Б на с. 477).
Эти ферменты гшридоксальфосфатзависимые.
Неокислительное дезаминирование гистидинапод действием фермента гистидазы (гистидин-аммиаклиазы) является внутримолекулярным, так как образование молекулы аммиака происходит из атомов самой аминокислоты без участия молекулы воды. Эта реакция происходит только в печени и коже (см. схему В на с. 477).
78. Обмен фенилаланина и тирозина. Особенности обмена тирозина в разных тканях. Синтез катихоламинов, меланинов, йодтиронинов. Наследственные биохимические блоки в распаде фенилаланина и тирозина: паркинсонизм, фенилкетонурия, алкаптонурия, альбинизм, диагностика и лечение.
Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически
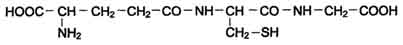
Схема ГГлутатион
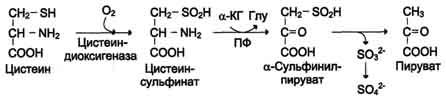
Схема A
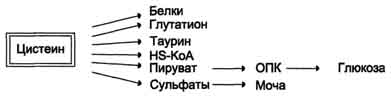
Схема Б
активных соединений. В разных тканях метаболизм этих аминокислот происходит поразному.
Метаболизм феиилаланина
Основное количество фенилаланина расходуется по 2 путям:
- включается в белки;
- превращается в тирозин.
Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает.
Основной путь метаболизма фенилаланина начинается с его гидроксилирования (рис. 9-29), в результате чего образуется тирозин. Эта реакция катализируется специфической монооксиге-назой - фенилаланингидр(жсилазой, кофермен-том которой служит тетрагидробиоптерин (Н4БП). Активность фермента зависит также от наличия Fe2+. Реакция необратима. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием NADPH + H+.
2. Особенности обмена тирозина
в разных тканях
Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и ка-таболизируется до СО2 и Н2О.
