Ионные равновесия в растворах. Ионное произведение воды.
Водородный показатель(pH)
Понятие константы диссоциации может быть применено и к растворителям, молекулы которых способны распадаться на ионы. Например, реакцию диссоциации воды можно представить в виде:
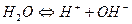
с константой диссоциации:
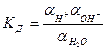
(для чистой воды и разбавленных растворов можно принять, что 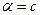 )
)
Так как степень диссоциации воды очень мала, можно считать активность воды постоянной величиной и внести ее в константу диссоциации:
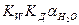 . Это выражение называется ионным произведением воды:
. Это выражение называется ионным произведением воды:
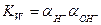 (32.7)
(32.7)
При 298 К 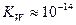 . В нейтральных растворах
. В нейтральных растворах
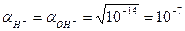
Приняв, что 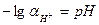 и
и 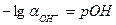 , и подставив эти выражения в уравнение (5.7), получим
, и подставив эти выражения в уравнение (5.7), получим
lg 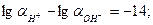 pH + pOH=14.
pH + pOH=14.
Отрицательный десятичный логарифм активности водородных ионов pH называют водородным показателем, а величину 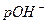 гидроксильным показателем. При 298К в нейтральной среде – pH = 7, в кислой – pH <7, и щелочной –pH > 7, но во всех случаях сумма pH и pOH равна 14.
гидроксильным показателем. При 298К в нейтральной среде – pH = 7, в кислой – pH <7, и щелочной –pH > 7, но во всех случаях сумма pH и pOH равна 14.
Буферные растворы
В природе и практической деятельности многие реакции протекают при определенном значении pH, которое должно быть постоянным и не зависеть от разведения, изменения состава раствора, добавления кислоты или щелочи и т.д. Такими свойствами обладают буферные растворы, содержащие слабую кислоту и соль, образованную этой кислотой и сильным основанием (например, ацетатный буфер  ), или слабое основание и соль, образованную сильной кислотой и этим основанием (например, аммиачный буфер
), или слабое основание и соль, образованную сильной кислотой и этим основанием (например, аммиачный буфер  ). Эти растворы обладают определенными свойствами, которые проиллюстрируем на примере ацетатного буфера.
). Эти растворы обладают определенными свойствами, которые проиллюстрируем на примере ацетатного буфера.
Присутствие ацетата натрия (сильного электролита), который полностью диссоциирован, настолько увеличивает концентрацию ионов CH  COO
COO 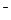 , что, в соответствии с принципом Ле-Шателье, диссоциация уксусной кислоты полностью подавляется:
, что, в соответствии с принципом Ле-Шателье, диссоциация уксусной кислоты полностью подавляется:
В результате можно считать, что в буферном растворе активность анионов равна активности анионов соли  , а активность кислоты равна ее концентрации
, а активность кислоты равна ее концентрации  . Подставляя эти величины в выражение константы диссоциации, логарифмируя и вводя обозначение
. Подставляя эти величины в выражение константы диссоциации, логарифмируя и вводя обозначение  получимследующие формулы:
получимследующие формулы:
 (32.9)
(32.9)
Эти формулы показывают, что pH буферного раствора зависит от константы диссоциации кислоты и соотношения аналитических концентраций соли и кислоты. При разбавлении буферного раствора это соотношение не меняется, а незначительное повышение pH обусловлено изменением коэффициента активности соли. Добавление сильной кислоты тоже сравнительно слабо отражается на изменении pH. При добавлении сильной кислоты к буферному раствору идет реакция с образованием недиссоциированной уксусной кислоты:
 а при добавлении сильного основания- реакция нейтрализации:
а при добавлении сильного основания- реакция нейтрализации:
 .
.
Ионы  в первом случае, и ионы
в первом случае, и ионы  во втором, связываются в малодиссоциированные молекулы (
во втором, связываются в малодиссоциированные молекулы (  и
и  ), в результате чего в pH раствора практически не изменяется.
), в результате чего в pH раствора практически не изменяется.
Способность буферных растворов противостоять изменению pH количественно выражается величиной, называемой буферной емкостью. Буферная емкость - это количество кислоты или щелочи которое нужно добавить к раствору, чтобы изменить его pH на единицу.
