Типы химических связей в органических соединениях
Типы химических связей в органических соединениях
Ковалентной связью называется внутримолекулярная химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов.
Сигма-связь – связь, образованная в результате перекрывания электронных облаков и расположенная на прямой, соединяющей центры ядер атомов.
Пи – связь – связь, образованная в результате перекрывания электронных облаков и расположенная вне прямой, соединяющей центры ядер атомов.
Виды изомерии в органических соединениях
Изомерия-явление сущ-ия Изомеров.Изомер-вещ-ва имеющие одинаковый сост-в атомов, но различное в строе ние.
А)Структурная изомер-я 1)Изомерия углеродного скелета.
Различая во взаимном расположении атомов С.
2)Изомерия по положению кратной связи
(двойной).
3)Из положения функциональной группы Различия положения функциональной группы относительно углеродного скеле та.
В)Пространственная изомер-я
Связана с различным положе нием атомов или групп атомов относительно двойной связи.(цис-(ванна) и транс-изомеря(кресло), зеркальная изоиерия)
Предельные углеводороды, их химические свойства.
 Алканы (парафины) - это насы щенные (предельные) углево дороды с открытой цепью. Они имеют общую формулу СnН2n+2, В алканах атомы углерода связаны между собой только простыми (одинарными) связями, а остальные валент ности углероданасыщены ато мами водорода. Характерный суффикс для насыщенных углеводородов-ан.,
Алканы (парафины) - это насы щенные (предельные) углево дороды с открытой цепью. Они имеют общую формулу СnН2n+2, В алканах атомы углерода связаны между собой только простыми (одинарными) связями, а остальные валент ности углероданасыщены ато мами водорода. Характерный суффикс для насыщенных углеводородов-ан.,
СН4 - метан; С2Н6 - этан; С3Н8 - пропан
С4Н10 - бутан (2 изомера)
С5Н12 - пентан (3 изомера)
С6Н14 - гексан , С7Н16 - гептан
С8Н18 - октан С9Н20 - нонан С10Н22 – декан
Химические св-ва:
1)Замещение: CH4+Cl2→CH3Cl+HCl (хлористый метил)
CH3Cl+HCl→CH2Cl2+HCl (хлористый метилен) CH2Cl2+Cl2→CHCl3+HCl (хлороформ)
3)Нитрование: характерно для имеющим вторичный или третичный атом углерода.

Р-я КОНОВАЛОВА
4)При температуре 100-500ºС и доступе кислорода образуются жирные кислоты, а при температуре 500-600ºС наблюдается крекинговый процесс
- р-я горения CH4+2O2 →CO2+H20(полное), 2СН4+О2à2СО+4Н2(неполное)
-Каталитическое окисление2СН3-СН2-СН2-СН3 + 5О2 →4СН3СООН (уксусная кислота),
-реакция отщипления:  (крекинг)
(крекинг)
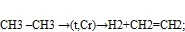
-изомеризация 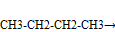
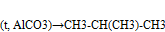
Получение алканов.
Получение метана
в промышленности:
1. Фракционированием природного газа и перегонкой нефти.
2. Синтез из элементов при высокой температуре (вольтова дуга),
C + 2H2 →CH4
Химические способы получения: 1)Из солей органических кислот. Cплавление ацета та натрия со щелочью: СН3СOONa + NaOH →CH4 + Na2CO3
2)Синтез Вюрца: CH3Cl+2Na+ClCH2-CH3→2NaCl+C3H8
3)Из магний органических соединений: CH3Br+Mg→CH3MgBr
CH3MgBr+H2O→CH4+Mg(OH)Br
4)Синтез Бертло: C2H5I+HI→C2H6+I2
5)Из алкенов 
6) Восстановление галогенпроизводных алканов. CH3Cl+H2→(p,pt)→CH4+HCl
Правила ориентации
1. Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее действие.
2. По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода.
Ориентанты 1-го рода (орто-пара-ориентанты) направляют последующее замещение преимущественно в орто- и пара-положения.
К ним относятся электронодонорные группы (электронные эффекты групп указаны в скобках):
-R (+I); -OH (+M,-I); -OR (+M,-I); -NH2 (+M,-I); -NR2 (+M,-I)
+M-эффект в этих группах сильнее, чем -I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто- и пара-положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.
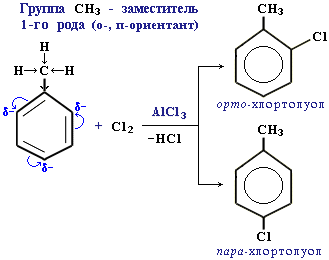 Пример:
Пример:
Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства:-F (+M<–I), -Cl (+M<–I), -Br (+M<–I).
Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце.
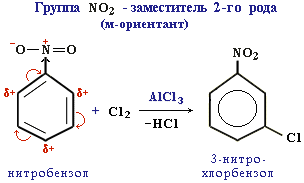
Ориентанты 2-го рода (мета-ориентанты) направляют последующее замещение преимущественно в мета-положение.
К ним относятся электроноакцепторные группы:
-NO2 (–M, –I); -COOH (–M, –I); -CH=O (–M, –I); -SO3H (–I); -NH3+ (–I); -CCl3 (–I).
Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто- и пара-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше.
Пример:
Все ориентанты 2-го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения.
Таким образом, легкость электрофильного замещения для соединений (приведенных в качестве примеров) уменьшается в ряду:
толуол C6H5CH3 > бензол C6H6 > нитробензол C6H5NO2.
Хим. Св-ва.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
1. Гидрирование карбонильных соединений, как и алкенов, идет в присутствии ката-
лизаторов (Ni, Pt, Pd). Из альдегидов при восстановлении образуются первичные спир-
ты, H-COH + H2→СH3OH;
2. Присоединение Н2О
R-COH+H2O=R-CH(OH)2 (двухатомный спирт) 3. Взаимодействие сенильной кислотой R-COH+H-CN=R-CH(OH)(CN) (оксинитрил)
4. Взаимодействие со спиртами R-COH+R1-OH=R-CH(OR1)(OH)(полуацеталь) R-COH+R1-OH=(t* HCl)=R-CH(OR1)(OR1) (ацеталь)
РЕАКЦИИ ЗАМЕЩЕНИЯ КАРБОНИЛЬНОЙ ГРУППЫ
CH3-COH+PCl5→CH3-CHCl2+POCl3
РЕАКЦИИ ОБУСЛОВЛЕННЫЕ ЗАМЕЩЕНИЕМ В РАДИКАЛЕ
CH3-COH+Br2=Br-CH2-COH+HBr (бромуксусный альдегид)
Р.ОКИСЛЕНИЯ
CH3-COH+Ag2O→CH3COOH+2Ag
Р.АЛЬДОЛЬНОЙ КОНЦЕНТРАЦИИ
CH3COH+ CH3COH→CH3-CH(CH3)-CH2-COH→CH3-CH=CH-COH+H2O
Получение альдегидов.
К альдегидам относят органические соединения, име ющие в своем составе карбо нильную группуС=О, соединен ную в альдегидах с одним углеводо родным радикалом
1 окисление метанола на медном катализаторе при 300О
CH3OH + O2 →2H-COH(формальдегид,муравьиный альдегид) + 2H2O;
2. Дегидрирование метанола в газовой фазе на катализаторе (Сu, Ni).СН3OH→H-COH + H2
С2H2 + H2O CH2=CH-OH CH3-COH(уксусный ангедр
3ЩЕЛОЧНОЙ ГИДРОЛИЗ ДИГАЛОГЕНПРОИЗВОДНЫХ
CH3-CHCl2+2NaOH→CH3-C(OH)3+2NaCl→CH3COH+H2O+2NaCl
4. Р.КУЧЕРОВА CH≡CH+H2O→CH3COH
Дикарбоновые кислоты.
Карбоновые кислоты - это производные углеводоро дов, имеющие в своем составе
одну или несколько карбоксиль ных групп. Общая формула карбоновых кислот - R-COOH. Карбоксильная группа в свою очередь состоит из
карбонильной (>С=О) и гидроксильной (-ОН) групп В зависимости от количества карбоксильных групп карбоновые кислоты делят на
одноосновные(монокарбоновые), двухосновные(дикарбоно вые) и многоосновные кислоты. Это орг.соединения содержа щие две карбоксильные групп пы. Двухосновные кислоты
НООС-СООН щавелевая (этандиовая)
НООС-СН2-СООН малоновая пропандиовая
НООС-СН2-СН2-СООН янтарная (бутандиовая)
НООС-СН2-СН2-СН2-СООНпентандиовая, глутаровая
НООС-СН2-СН2-СООН янтарная=(-Н2О)=ангидрид янтарной кислоты
ПОЛУЧЕНИЕ:
1)окисление 2хатомных спиртов CH2(OH)- CH2(OH)→[O],-H2O→COH-COH→[O]→COOH-COOH
2)из дигалогенпроизводных Cl-CH2-CH2-Cl→(2KCl)→N≡C-CH2-CH2-C≡N→(+6H2O,-2NH3)→HOOC-CH2-CH2-COOH+2H2O
ХИМИЧЕСКИЕ СВ-ВА
1)реакции замещения
COOH-COOH→(+NaOH,-H2O)→ COONa-COOH→(+NaOH,-H2O)→ COONa-COONa
2)выдеоение СО2 при нагревание
COOH-COOH→CO2+HCOOH
COOH-CH2-COOH→CO2+CH3COOH
3)выделение Н2О принагревание
СООН-CH2-CH2-COOH→(t,-H2O)→ (-CH2-COOOC-CH2-)ЦИКЛ
4) COOH-COOH→[O]→CO2+CO+H2O
5) COOH-CH2-COOH+2C2H5O→CO(O-C2H5)-CH2-CO(O-C2H5)+H2O
6) СООН-CH2-CH2-COOH+2NH4OH→ СООNH4-CH2-CH2-COONH4→(-H2O)→ СОNH2-CH2-CH2-CONH2→(-NH3)→(-CH2-C(O)-NH-C(O)-CH2-)→(-CH=CH-NH-CH=CH-)
Хим св-ва
1)Хар-ны все реакции на карбоксильную группу-окисление
-образование простых эфиров
-образование двух видов сложных эфиров
-разложение при нагревании
-выделение воды при нагревании(альфа кислоты)
Бета кислоты
Гама кислоты
Оптическая изомерия.
Коламин

Серин
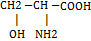
Лецетин


Ди - и трипептиды.
–этоорганические вещества, молекулы которых построены из аминокислот, соединённых пептидной связью. В зависимости от числа входящих в молекулу аминокислот различают дипептиды, трипептиды и т.д., а также полипептиды. Как правило, молекулы пептидов линейны, причём один конец цепи заканчивается карбоксильной группой (-СООН), а другой – аминогруппой (—NH2 ). Но цепь может быть и замкнута в циклическую структуру. Присоединение происходит за счет выделения воды из карбонильной группы одной а/к и аминогруппы другой. Так как белки синтезируются в виде полипептидных цепей, граница между полипептидом и простым белком условна. Пептидами являются многие важные для организмов вещества – некоторые гормоны, антибиотики, токсины.
Нуклеозиды и нукпеотиды.
Нуклеиновые кислоты состоят из мононуклеотидов. Нуклеотид состоит из трёх компонентов: 1.азотистое основание (пуриновое или перимединовое), 2.сахар: рибоза (С5Н10О5) или дезоксирибоза C5H10O4.,фосфорная к-та. Пуриновые основания.Родоначальник – ПУРИН:
Аденин:
Гуанин:
Пиримидиновые основания.ПИРИМИДИН:
Урацил:
Цитозин:
Тимин:
Азотистые основания:АМФаденозинмонофосфат (адениловая к-та):
АТФ аденозинтрифосфат:
Нуклеозиды – это нуклеотиды без фосфорной кислоты. Аденозин:
Присоединение фосфорной к-ты возможно по трем положениям гидроксогрупп рибозы: 2, 3, 5. Аденин, гуанин и цитозин входят как в ДНК, так и РНК. Тимин – только в ДНК, урацил – только в РНК.
Схема строения РНК и ДНК.
Структура ДНК:цепь ДНК представляет собой углеводофосфатную последовательность, с которой соединены азотистые основания. Молекулы фосфорной кислоты соединяют собой молекулы оксирибозы, группы ОН 3 и 5 углерода. Молекула ДНК имее 2 цепи нуклеотидов, расположенных параллельно друг другу. Эти две цепи удерживаются за счет водородных связей. Комплементарность обеспечивает одинаковое расстояние между азотистыми основаниями. Последовательность азотистых оснований одной цепи строго соответствует последовательность оснований другой цепи.
Структура РНК. Нить РНК –этопоследовательность рибонуклеотидов, соединенных в одну цепь. (линейная структура).Соединение рибонуклеотидов между собойосуществляется эфирной связью между 3-ей –ОН рибозы одного нуклеотида и 5-ой –ОН рибозы следующего нуклеотида. Азотистые основания РНК – А и Г (пуриновые) и Ц и У (пиримидиновые). А и Г присоединяются к пентозе черезN 9-ого положения. Ц и У – через атом N в 1-ом положении. Отличительная особенность ДНК от РНК то, что для неё не характерно устойчивое спиральное строение. Она линейна. РНК)
Диализ. Электрофорез.
Диализ- это метод очистки белковых растворов от низкомолекулярных примесей. Для проведения диализа необходим цилиндр, у которого вместо дня ППМ, поры которой пропускают мелкие молекулы, но не пропускают молекулы белков. Цилиндр с раствором белка с примесями погружается в емкость с дистиллированной водой. Мелкие молекулы примесей свободно проходят через поры мембраны, равномерно распределяясь между областями внутри и снаружи цилиндра. Для полной очистки необходимо погружать цилиндр в проточную воду. С помощью диализа очищаются белковые растворы фармакологической промышленности. Этот метод лежит в основе «искусственной почки».
Электрофарез – это метод разделения белков на отдельные фракции. В основе работы аппарата эф лежит способность заряженных белковых молекул двигаться в электрическом поле к противоположно заряженному электроду. Различные молекулы – различная скорость, зависящая от молекулярной массы, суммарного заряда, формы. Аппарат для эф состоит из горизонтально расположенного носителя (гелиевого) и электродов, создающих электрическое поле. На носитель наносится раствор с электролитами. Исследуемый раствор наносят в стартовую зону и подают напряжение. Через определенный промежуток времени белки с разной молекулярной массой распределяются по зонам. Из каждой зоны белки можно извлечь и измерить количественно.
Катализ. Виды катализа.
Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами).
Гомогенный катализ – катализатор и реагенты находятся в одной фазе.
Гетерогенный катализ – катализатор обычно твердый, а реакция протекает на его поверхности.
Адсорбция, суть, значение.
Адсорбция – оседание частиц на поверхности адсорбента. Активированный уголь в противогазах защищает от воздействия ядовитых газов.
67)Хроматография:
Хроматография – метод разделения и анализа смесей веществ и изучения физико – химических свойств веществ, основан на распределении компонентов между двумя фазами: подвижной и неподвижной. Неподвижной служит твердое вещество(сорбент) или пленка жидкости, нанесенное на твердое вещество. Подвижная – это жидкость или газ, протекаемый через неподвижную фазу. Можно очищать вещество от примесей.
Явление диффузии.
Диффузия – односторонний переход растворимого вещества из большей концентрации в меньшую.
Типы химических связей в органических соединениях
Ковалентной связью называется внутримолекулярная химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов.
Сигма-связь – связь, образованная в результате перекрывания электронных облаков и расположенная на прямой, соединяющей центры ядер атомов.
Пи – связь – связь, образованная в результате перекрывания электронных облаков и расположенная вне прямой, соединяющей центры ядер атомов.
