Классификация реакций в органической химии
Реакции в органической химии классифицируют по изменению, происходящему с органическим веществом – субстратом.
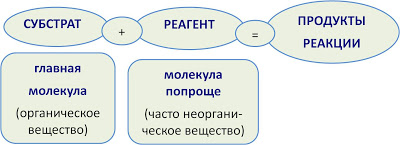
Химические реакции в органической химии можно классифицировать по различным признакам:
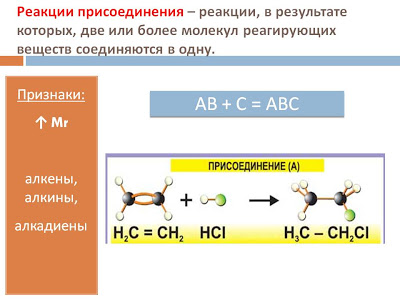
1. По типу химического превращения:



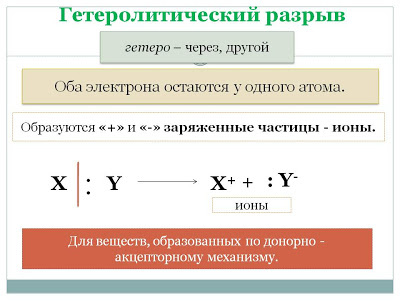
2. по способу разрыва связи:

Кроме приведенных типов реакций, встречаются и другие: окисление, пиролиз, конденсация, восстановление.
· Источники: ресурсы Интернет, О.С. Габриелян Методическое пособие, А.И. Артеменко удивительный мир органической химии.
Урок 4
Углеводороды. Классификация. План характеристики. Алканы (Теоретический материал)
Предельные углеводороды.
Предельные углеводороды - это углеводороды, в молекулах которых имеются только простые (одинарные) связи (  -связи). Предельными углеводородами являются алканы и циклоалканы.
-связи). Предельными углеводородами являются алканы и циклоалканы.
Атомы углерода в предельных углеводородах находятся в состоянии sp3-гибридизации.
Алканы
Алканы - предельные углеводороды, состав которых выражается общей формулой CnH2n+2. Алканы являются насыщенными углеводородами.
Изомеры и гомологи
| Г о м о л о г и | CH4 метан | |||
| CH3—CH3 этан | ||||
| CH3—CH2—CH3 пропан | ||||
| CH3—(CH2)2—CH3 бутан |  2-метилпропан 2-метилпропан | |||
| CH3—(CH2)3—CH3 пентан | 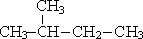 2-метилбутан 2-метилбутан |  2,2-диметилпропан 2,2-диметилпропан | ||
| CH3—(CH2)4—CH3 гексан |  2-метилпентан 2-метилпентан |  2,2-диметилбутан 2,2-диметилбутан |  2,3-диметилбутан 2,3-диметилбутан | 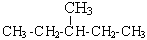 3-метилпентан 3-метилпентан |
| и з о м е р ы |
Физические свойства алканов
При комнатной температуре С1-C4 - газы, C5-C15 - жидкости, C16 и следующие - твердые вещества; нерастворимы в воде; плотность меньше 1 г/см3; жидкие - с запахом бензина.
С увеличением числа атомов углерода в молекуле возрастает температура кипения.
Химические свойства алканов
Малоактивны в обычных условиях, не реагируют с растворами кислот и щелочей, не обесцвечивают раствор KMnO4 и бромную воду.
- Горение (окисление с разрывом связей C—C и C—H): CH4 + 2O2
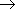 CO2 + 2H2O + Q
CO2 + 2H2O + Q - Замещение (с разрывом связей C—H):
а) галогенирование (только с хлором и с бромом):
1-я стадия: CH4 + Cl2 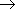 CH3Cl + HCl (при нагревании или на свету).
CH3Cl + HCl (при нагревании или на свету).
При достаточном количестве галогена происходит дальнейшее замещение атомов водорода:
| CH3Cl хлорметан | + Cl2 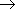 | CH2Cl2 дихлорметан | + HCl, |
CH2Cl2 + Cl2 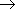 | CHCl3 трихлорметан | + HCl, |
CHCl3 + Cl2 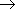 | CCl4 тетрахлорметан | + HCl. |
б) нитрование (реакция Коновалова):
CH4 + HONO2 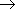 | CH3NO2 нитрометан | + H2O (при нагревании) |
Получение алканов
Лабораторные способы:
- Гидролиз карбида алюминия (получение метана): Al4C3 + 12H2O
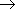 4Al(OH)3 + 3CH4
4Al(OH)3 + 3CH4 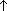
- Реакция обмена: CH3COONa + NaOH
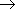 Na2CO3 + CH4
Na2CO3 + CH4 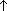 (при нагревании)
(при нагревании) - Реакция Вюрца: 2CH3Cl + 2Na
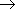 CH3—CH3 + 2NaCl
CH3—CH3 + 2NaCl
Промышленные способы:
- Выделение из природных источников (природного газа, нефти, каменного угля, горючих сланцев).
- Газификация твердого топлива: C + 2H2
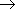 CH4 (при нагревании под давлением в присутствии Ni-катализатора)
CH4 (при нагревании под давлением в присутствии Ni-катализатора)
Циклоалканы
Циклоалканы - предельные углеводороды, состав которых выражается формулой CnH2n. В состав молекул циклоалканов входят замкнутые углеродные цепи (циклы).
Изомеры и гомологи
| Г о м о л о г и | Циклопропан C3H6 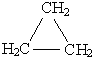 или или  | |||
Циклобутан C4H8  или или  | Метилциклопропан 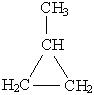 | |||
Циклопентан C5H10  или или 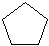 | Метилциклобутан 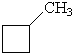 | 1,1-диметил-циклопропан  | 1,2-диметил-циклопропан  | Этилциклопропан  |
| И з о м е р ы |
Упрощенно углеводородный цикл часто изображают правильным многоугольником с соответствующим числом углов. Физические свойства мало отличаются от свойств алканов.
Химические свойства
За исключением циклопропана и циклобутана циклоалканы, как и алканы, малоактивны в обычных условиях.
Общие свойства циклоалканов (на примере циклогексана):
1. горение (окисление с разрывом связей C—C и C—H):
C6H12 + 9O2  6CO2 + 6H2O + Q
6CO2 + 6H2O + Q
2. замещение (галогенирование, нитрование):
C6H12 + Cl2  C6H11Cl + HCl (при нагревании или на свету)
C6H11Cl + HCl (при нагревании или на свету)
3. присоединение (гидрирование):
C6H12 + H2  C6H14 (при нагревании под давлением в присутствии Ni-катализатора)
C6H14 (при нагревании под давлением в присутствии Ni-катализатора)
4. разложение (дегидрирование, крекинг, пиролиз):
C6H12 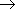 C6H6 + 3H2 (при нагревании с катализатором).
C6H6 + 3H2 (при нагревании с катализатором).
Особые свойства циклопропана и циклобутана (склонность к реакциям присоединения):
1. галогенирование:
 + Br2
+ Br2 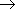 BrCH2—CH2—CH2Br
BrCH2—CH2—CH2Br
2. гидрогалогенирование:
 + HBr
+ HBr 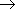 CH3—CH2—CH2Br
CH3—CH2—CH2Br
