Удельная электрическая проводимость
ТД электрохимических систем. Связь между тепловым эффектом, изменением ТД потенциала и электрической энергией в обратимых электрических системах. Равновесный и стандартный электродный потенциал. Типы электродов.
Предмет электрохимии
Предметом электрохимии, по определению А. Н. Фрумкина, является изучение превращения веществ на границе раздела проводников электричества первого рода и второго рода, происходящие с участием свободных электронов. Эти превращения и называют электрохимическими реакциями. Особенность их состоит в том, что это реакции эти реакции протекают не на такой гетерогенной границе, на которой электронная проводимость электрического тока заменяется ионной.
Если опустить кусок металлического цинка в раствор водный раствор соляной кислоты, то произойдет окисление атомов цинка и восстановление ионов водорода:
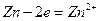
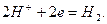
Гетерогенную химическую реакцию 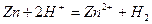 можно провести и не приводя в соприкосновение цинк и соляную кислоту - если в одну часть сосуда, разделенного диафрагмой[2] налить раствор хлорида цинка и погрузить в него пластину металлического цинка, а в другую часть - соляную кислоту и погрузить в нее платиновую пластину, замкнув пластины проводником первого рода.
можно провести и не приводя в соприкосновение цинк и соляную кислоту - если в одну часть сосуда, разделенного диафрагмой[2] налить раствор хлорида цинка и погрузить в него пластину металлического цинка, а в другую часть - соляную кислоту и погрузить в нее платиновую пластину, замкнув пластины проводником первого рода.
После замыкания пластин на границе цинк-раствор начнется самопроизвольные реакции окисление цинка (анодный процесс), а на границе платина-соляная кислота- восстановления ионов водорода (катодный процесс). Ионы же хлора не участвуют в электрохимических реакциях. При протекании химической реакции электроны не образуются и не исчезают, а только переходят от одной частицы к другой, поэтому окислительное и восстановительное превращения должны всегда протекать одновременной и в эквивалентных количествах.
Ионы, непосредственно участвующие в электрохимических реакциях (в данном случае 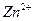 и
и 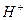 ), называют потенциал-определяющими ионами. Ионы же хлора в этих реакциях не участвуют.
), называют потенциал-определяющими ионами. Ионы же хлора в этих реакциях не участвуют.
Проводник первого рода, находящийся в контакте с проводником второго рода, называется электродом, а ионопроводящая среда в электрохимической системе называется электролитом. Этим же термином обозначают обычно и вещество, ионы которого переносят ток.
Такая система, которая состоит из проводников первого рода и находящихся в соприкосновении с ними проводников второго рода называется электрохимической системой[3].
Классификация электродов
В основу классификации электродов положены свойства веществ, участвующие в потенциал-определяющих процессах. Принято различать электроды первого рода, второго рода, газовые, окислительно-восстановительные и др. расчет потециалов, которых производится по Уравнению Нернста (33.19).a
Электроды первого рода - это электроды, в которых твердой фазой является металл или металлоид. Потенциал электрода первого рода зависит от активности лишь одного определенного сорта ионов. В случае металлических электродов первого рода такими ионами будут катионы металла 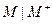 а в случае металлоидных - анионы металлоида (и электроды называют, оответственно обратимыми относительно катиона или аниона).
а в случае металлоидных - анионы металлоида (и электроды называют, оответственно обратимыми относительно катиона или аниона).
Электродную реакцию записывают соответственно как
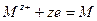
Тогда выражение для электродного потенциала для электрода первого рода будет:
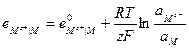 (33.20)
(33.20)
Если учесть, что активность чистого твердого вещества при заданной температуре постоянна и принять ее условно равной единице, то:
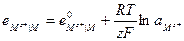
Например, серебряный электрод первого рода записывается в виде 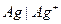 Ему отвечает реакция
Ему отвечает реакция
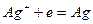
и его электродный потенциал
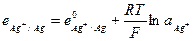
Примером металлоидных электродов первого рода может служить селеновый электрод 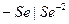 на котором протекает реакция
на котором протекает реакция
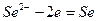
и его электродный потенциал
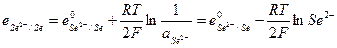
Газовые электроды, выделены в особую группу электродов, более сложную в конструктивном оформлении.
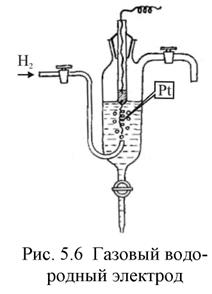
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Газовый электрод невозможен без участия металлического проводника. Металл газового электрода должен быть инертным и поэтому чаще всего используют платину или углерод. В качестве примера на рис. 5 схематически изображена конструкция водородного электрода. Водородные электроды используют в качестве стандартных: принято, что при всех температурах и при парциальном давлении водорода равном 1 атм, 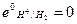
Газовый водородный электродможно представить схемой 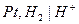 . Ему отвечает электродная реакция:
. Ему отвечает электродная реакция:
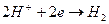
и его электродный потенциал
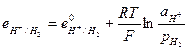
 (33.21)
(33.21)
 | Из выражения (33.21) видно, что потенциал водородного электрода определяется не только активностью водородных ионов, но и парциальным давлением водорода. Согласно определению условной шкалы электродных потенциалов, стандартный потенциал водородного электрода всех температурах принят равным нулю и при парциальном давлении водорода равном 1 атм, и учитывая, что 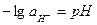 уравнение (33.21) упрощается: уравнение (33.21) упрощается: 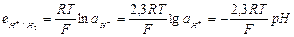 (33.22) Или (33.22) Или 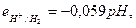 |
Кислородный электрод.Кислородный газовый электрод изображают в виде схемы 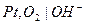 и он имеет конструкцию аналогично водородному электроду. Реакцию, протекающую на кислородном электроде, можно записать:
и он имеет конструкцию аналогично водородному электроду. Реакцию, протекающую на кислородном электроде, можно записать:
Ему отвечает электродная реакция:
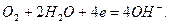
и его электродный потенциал
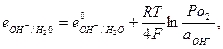
причем в величину е° включена активность воды. Выражение для равновесного кислородного электрода можно записать в виде
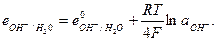
Электроды второго рода представляют собой полуэлементы, состоящие из металла, покрытого слоем его труднорастворимого соединения (соли, оксида или гидрооксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла (рис. 6).
Например, в хлор-серебряном электроде протекают реакции, в которых участвуют и ионы серебра и ионы хлора:
Ему отвечает электродная реакция:
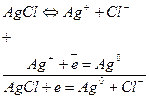
и его электродный потенциал
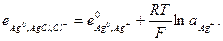 (33.23)
(33.23)
Потенциал электрода второго рода можно рассчитать и по активности аниона: поскольку 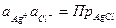 и
и 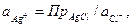
то 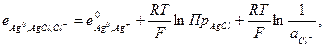 (33.24)
(33.24)
так как произведение растворимости постоянная величина, то ее можно внести в выражение стандартного потенциала
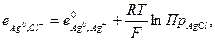
тогда
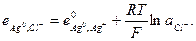 (33.25)
(33.25)
Величины потенциалов электродов второго рода легко воспроизводимы и
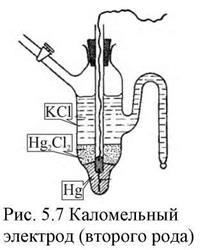 | устойчивы. Эти электроды часто применяются в качестве электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее часто применяются каломельные электроды 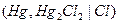 в которых протекает суммарная реакция в которых протекает суммарная реакция 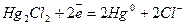 , а так же ртутно-сульфатные, хлор-серебряные, ртутно-окисные и сурьмяные. Окислительно восстановительные или редок- си-электроды , а так же ртутно-сульфатные, хлор-серебряные, ртутно-окисные и сурьмяные. Окислительно восстановительные или редок- си-электроды |
представляют собой, инертную, обычно платиновую пластину, погруженную в раствор, содержащий одновременно, ионы в двух формах окисления (например, 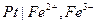 или
или 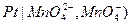 , а электродная реакция сводится к перемене валентности ионов без изменения их состава
, а электродная реакция сводится к перемене валентности ионов без изменения их состава 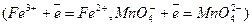 и т.д. Инертный проводник первого рода играет роль донора или акцептора электронов. Для редокс электродов отвечает электродная реакция:
и т.д. Инертный проводник первого рода играет роль донора или акцептора электронов. Для редокс электродов отвечает электродная реакция:
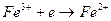
и его электродный потенциал
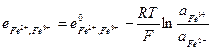 (33.26)
(33.26)
Из других типов электродов следует упомянуть стеклянные электроды, которые находят широкое применение.
Электродвижущая сила
Из полуэлементов, обладающих различными равновесными электродными потенциалами, можно составить электрохимическую систему (рис. 8). По внешней цепи (по проводникам первого рода) электроны переходят с электрода на ион, при этом этот ион восстанавливается. На втором электроде наоборот электроны от иона переходят на электрод и при этом
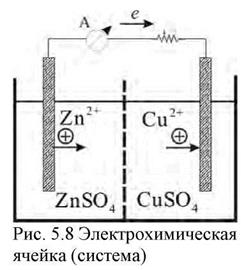 | ион окисляется. При этом энергия реакции превращается в электрическую энергию. Схематически любую электрохимическую систему принято записывать следующим образом: слева указывается тот электрод, на котором идет процесс окисления, затем примыкающий к нему электролит, далее раствор, контактирующий со вторым электродом и, наконец, второй электрод на котором идет процесс восстановления 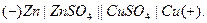 |
При этом в системе протекают реакции:
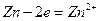
с электродным потенциалом
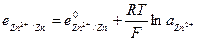
и 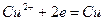 и с электродным потенциалом
и с электродным потенциалом
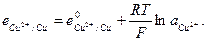
Если ток, протекающий в цепи очень мал (внешнее сопротивление цепи очень велико) электрохимический процесс будет медленным и осуществляться в условиях близких к равновесным. В этом случае работа, совершаемая системой будет близка к максимальной, а разность потенциалов в цепи - наибольшей. Такая наибольшая разность потенциалов в электрохимической цепи называется электродвижущей силой (ЭДС).
ЭДС цепи E представляет собой алгебраическую сумму отдельных скачков потенциала, возникающих на границе раздела между различными фазами, участвующими в образовании цепи. ЭДС рассчитывается как разность потенциалов электродов, на котором идет процесс восстановления 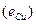 , и электрода на котором идет процесс окисления
, и электрода на котором идет процесс окисления 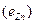 ЭДС всегда положительна:
ЭДС всегда положительна:
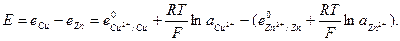 (33.28)
(33.28)
При равновесных потенциалах электродов измеряется стандартная 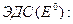
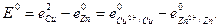 (33.29)
(33.29)
Диффузионный потенциал
В общем случае, при расчете ЭДС цепи следует учитывать не только скачки потенциала на границе между проводниками первого и второго рода, но и на границе между растворами электролитов, возникающими вследствие того, что скорости диффузии катионов и анионов различны. Для двух растворов с одинаковым растворителем такой скачок называется диффузионным потенциалом 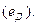 В этом случае ЭДС цепи рассчитывается с учетом диффузионного потенциала:
В этом случае ЭДС цепи рассчитывается с учетом диффузионного потенциала:
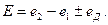 (33.30)
(33.30)
Диффузионный потенциал можно устранить с помощью электролитического мостика, заполненного раствором такого электролита, у которого подвижности аниона и катиона близки по величине (например, 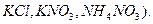
Если диффузионный потенциал между двумя различными растворами полностью устранен, то такие цепи носят название цепей без переноса, и на схеме растворы отделяются друг от друга двумя сплошными вертикальными линиями (||)а если не устранен - вертикальной пунктирной линией  . Цепи, в которых он не устранен и происходит непосредственный перенос электролита из одного раствора в другой, называют цепями с переносом.
. Цепи, в которых он не устранен и происходит непосредственный перенос электролита из одного раствора в другой, называют цепями с переносом.
Законы Фарадея
Если замкнуть электрохимическую систему проводником первого рода или подключить ее к внешнему источнику тока, то через нее начнет проходить электрический ток. На границах изменения типа электрической проводимости происходят химические превращения веществ. Так как каждый элементарный акт электрохимической реакции сопровождается выделением или присоединением одного или нескольких электронов, то естественно, что чем большее число электронов пройдет через границу раздела проводник первого рода- проводник второго рода, тем больше будет прореагировавшая масса веществ - участников реакции.
Поскольку число прошедших через границу раздела электронов есть количество электричества, то изложенные выше соображения приводят к двум фундаментальным законам, открытым в 1833-1834 годах Фарадеем. Первый закон Фарадея может быть сформулирован так:
Если на границе раздела проводник первого рода - проводник второго рода при прохождении постоянного электрического тока протекает одна электрохимическая реакция, то масса каждого из участников реакции, претерпевших превращение, прямо пропорциональна количеству прошедшего через границу электричества.
Первый закон Фарадея, таким образом, можно представить уравнением
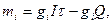 (33.37)
(33.37)
где 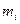 масса
масса 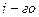 вещества, претерпевшего превращение;
вещества, претерпевшего превращение; 
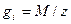 - фактор пропорциональности, называемый электрохимическим эквивалентом и показывающий, какое количество вещества претерпело превращение при прохождении через границу единицы количества электричества; I-постоянный ток, проходящий через границу раздела;
- фактор пропорциональности, называемый электрохимическим эквивалентом и показывающий, какое количество вещества претерпело превращение при прохождении через границу единицы количества электричества; I-постоянный ток, проходящий через границу раздела; 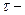 продолжительность прохождения тока;
продолжительность прохождения тока; 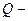 количество прошедшего электричества;
количество прошедшего электричества; 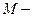 молекулярный вес металла; z- число электронов участвующих в реакции.
молекулярный вес металла; z- число электронов участвующих в реакции.
Электрический ток, проходящий через границу раздела и вызывающий электрохимическое превращение, называется фарадеевским током. В зависимости, от того, в каких единицах выражены 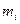 и
и 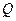 электрохимический эквивалент имеет разные значения и единицы измерения. Если
электрохимический эквивалент имеет разные значения и единицы измерения. Если 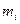 выражена в граммах или молях, а
выражена в граммах или молях, а 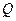 - в кулонах, то электрохимический эквивалент - в граммах на кулон или молях на кулон. В прикладной электрохимии единицей количества электричества обычно является ампер-час, равный 3600 Кл. Тогда
- в кулонах, то электрохимический эквивалент - в граммах на кулон или молях на кулон. В прикладной электрохимии единицей количества электричества обычно является ампер-час, равный 3600 Кл. Тогда 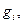 будет выражено в граммах на ампер-час или молях на ампер-час.
будет выражено в граммах на ампер-час или молях на ампер-час.
Число молекул или ионов в одном моле вещества равно числу Авогадро 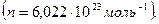 Если каждая молекула или ион в электрохимической реакции вступает во взаимодействие с z электронами, то превращение одного моля вещества будет связано с затратой или освобождением zen количества электричества (где е— заряд электрона). Соответственно превращение, вызванное одним молем электронов, будет: zen/z=F=en. Величина F одна и та же для всех реакций и называется константой Фарадея . Численно она равна:
Если каждая молекула или ион в электрохимической реакции вступает во взаимодействие с z электронами, то превращение одного моля вещества будет связано с затратой или освобождением zen количества электричества (где е— заряд электрона). Соответственно превращение, вызванное одним молем электронов, будет: zen/z=F=en. Величина F одна и та же для всех реакций и называется константой Фарадея . Численно она равна:
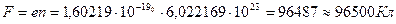 на моль электронов.
на моль электронов.
Первый закон Фарадея, базирующийся на атомистической природе вещества и электричества, является точным законом природы. Отклонений от него нет. Если на электроде протекает несколько параллельных электрохимических реакций, то первый закон Фарадея будет справедлив для каждой из них (с учетом всех возможных побочных химических реакций, сопутствующих данной электрохимической реакции).
Для практических целей введено понятие выхода по току 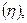 т. е доли тока, приходящейся на данное вещество. Следовательно, если на электроде протекает только одна электрохимическая реакция и нет побочных процессов, то выход по току
т. е доли тока, приходящейся на данное вещество. Следовательно, если на электроде протекает только одна электрохимическая реакция и нет побочных процессов, то выход по току 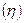 равен единице (или 100%). Если же на электроде протекают несколько параллельных реакций и имеются побочные процессы, то выход по току
равен единице (или 100%). Если же на электроде протекают несколько параллельных реакций и имеются побочные процессы, то выход по току 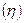 меньше единицы и количественно определяется из выражений
меньше единицы и количественно определяется из выражений
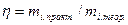 или
или 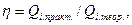 (33.38)
(33.38)
где 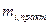 - масса i-го вещества, практически превратившегося в результате прохождения
- масса i-го вещества, практически превратившегося в результате прохождения 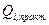 - количества электричества необходимое для превращения той же единицы i-го вещества;
- количества электричества необходимое для превращения той же единицы i-го вещества; 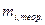 - масса i-го вещества, которая должна превратиться теоретически при прохождении
- масса i-го вещества, которая должна превратиться теоретически при прохождении 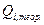 по закону Фарадея для превращения единицы i-го вещества, для которого рассчитывается выход по току. Выходы по току для процессов, протекающих на катоде, как правило, не совпадают с выходами по току анодных процессов, поэтому введено понятие катодного
по закону Фарадея для превращения единицы i-го вещества, для которого рассчитывается выход по току. Выходы по току для процессов, протекающих на катоде, как правило, не совпадают с выходами по току анодных процессов, поэтому введено понятие катодного 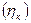 и анодного
и анодного 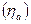 выходов по току.
выходов по току.
Второй закон Фарадея является непосредственным следствием первого закона. Согласно второму закону Фарадея:
Если на границе раздела проводник первого рода - проводник второго рода протекает одна, и только одна, электрохимическая реакция, в которой участвует несколько веществ, то массы участников реакции, претерпевших превращения, относятся друг к другу как их химические эквиваленты.
Электрохимические системы, в которых нет параллельных электрохимических и побочных химических реакций, и следовательно 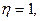 используют для измерения количества прошедшего электричества. Они называются кулоно-метрами (кулометрами) или вольтамперометрами. Наиболее точные результаты получают при использовании системы с серебряными или медными электродами.
используют для измерения количества прошедшего электричества. Они называются кулоно-метрами (кулометрами) или вольтамперометрами. Наиболее точные результаты получают при использовании системы с серебряными или медными электродами.
[1] Электрической проводимостью при бесконечном разбавлении, т.е. при бесконечно малой концентрации, и обозначают как
[2] Части сосуда могут быть разделены не диафрагмой, а сплошной перегородкой, и сообщаться друг с другом через электролитический мостик. Мембрана или электролитический мостик обеспечивают электрическую проводимость между растворами, но препятствуют их смешению.
[3] Понятию электрохимическая система эквивалентны часто встречающиеся в литературе названия гальванический элемент, электрохимическая ячейка, цепь.
ТД электрохимических систем. Связь между тепловым эффектом, изменением ТД потенциала и электрической энергией в обратимых электрических системах. Равновесный и стандартный электродный потенциал. Типы электродов.
Удельная электрическая проводимость
Мерой способности веществ проводить электрический ток является электрическая проводимость 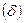 величина, обратная электрическому сопротивлению R. Так как по закону Ома
величина, обратная электрическому сопротивлению R. Так как по закону Ома 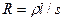 , то
, то
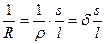 или
или 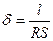 , (33.1)
, (33.1)
где 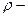 удельное сопротивление, Ом/м;
удельное сопротивление, Ом/м; 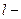 длина проводника, м;
длина проводника, м; 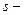 его поперечное сечение,
его поперечное сечение, 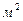 ;
; 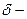 удельная электрическая проводимость
удельная электрическая проводимость 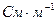 .
.
Удельная электрическая проводимость раствора электролита - это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 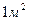 и расположенными на расстоянии
и расположенными на расстоянии 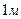 друг от друга.
друг от друга.
Удельная электрическая проводимость раствора электролита определяется количеством всех видов ионов, переносящих электричество, их скоростью и зарядом
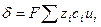 . (33.2)
. (33.2)
Для раствора симметричного электролита 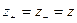 при концентрации c (моль/л), и при степени диссоциации
при концентрации c (моль/л), и при степени диссоциации 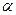 имеем
имеем
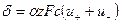 . (33.3)
. (33.3)
Ход зависимости удельной электрической проводимости растворов от концентрации электролитов, показан на рис. 5.1.
При c=0 удельная проводимость раствора определяется удельной
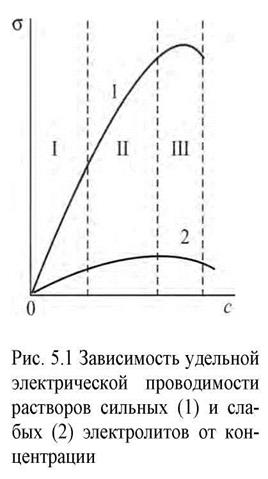 | проводи  мостью чистого растворителя. Поскольку вода является очень слабым электролитом, то для водных растворов мостью чистого растворителя. Поскольку вода является очень слабым электролитом, то для водных растворов 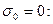 кривые кривые 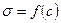 исходят из начала координат. У сильных электролитов степень диссоциации равна 1. Поэтому удельная проводимость должна возрастать пропорционально росту концентрации, что и наблюдается в области значительных разбавлений (участок I). Но при дальнейшем увеличении количества ионов в растворе усиливаются межионные взаимодействия, и темп роста проводимости замедляется (II), а в области высоких концентраций влияние тормозящих эффектов может привести даже к уменьшению удельной проводимости (III). исходят из начала координат. У сильных электролитов степень диссоциации равна 1. Поэтому удельная проводимость должна возрастать пропорционально росту концентрации, что и наблюдается в области значительных разбавлений (участок I). Но при дальнейшем увеличении количества ионов в растворе усиливаются межионные взаимодействия, и темп роста проводимости замедляется (II), а в области высоких концентраций влияние тормозящих эффектов может привести даже к уменьшению удельной проводимости (III). |
У слабых электролитов при росте концентрации степень диссоциации 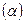 и, следовательно, количество заряженных частиц уменьшается. Поэтому удельная проводимость таких растворов значительно меньше проводимости растворов сильных электролитов.
и, следовательно, количество заряженных частиц уменьшается. Поэтому удельная проводимость таких растворов значительно меньше проводимости растворов сильных электролитов.
Силы торможения определяются ионной силой раствора, природой растворителя и температурой. Для одного и того же электролита при прочих равных условиях они возрастают с увеличением концентрации раствора.
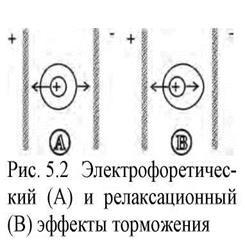
Эффект электрофоретического торможения (рис. 2, А) возникает вследствие того, что центральный ион и его ионная атмосфера обладают противоположными по знаку зарядами. При наложении на раствор электролита электрического поля ионы, входящие в ионную атмосферу, движутся в навстречу центральному иону. Следовательно, движущийся центральный ион находится под влиянием тормозящей силы, названной электрофоретической силой трения, что приводит к снижению его скорости.
Эффект релаксационного торможения (рис. 2 , В), возникает вследствие того, что при движении иона в электрическом поле нарушается центральная симметрия ионной атмосферы: перемещение иона сопровождается разрушением ионной атмосферы в одном положении иона и формированием ее в другом, новом. Данный процесс протекает с конечной скоростью в течение некоторого времени, называемого временем релаксации. Позади движущегося иона, потерявшего центральную симметрию, всегда будет некоторый избыток заряда противоположного знака. Силы электростатического притяжения, возникающие при этом, будут тормозить движение иона.
 | В электрических полях высокого напряжения 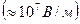 скорость движения ионов становится настолько большой, что ионная атмосфера не успевает образоваться, вследствие чего оба тормозящих эффекта отсутствуют (эффект Вина). В электрических полях высокой частоты скорость движения ионов становится настолько большой, что ионная атмосфера не успевает образоваться, вследствие чего оба тормозящих эффекта отсутствуют (эффект Вина). В электрических полях высокой частоты 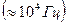 центральный ион очень быстро колеблется, не выходя центральный ион очень быстро колеблется, не выходя |
за пределы окружающей его атмосферы, которая не успевает разрушиться. Вследствие этого релаксационное торможение исчезает и остается лишь электрофоретическое торможение (эффект Дебая - Фалькенгаге-на).
В 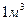 растворов разных концентраций содержатся различные количества растворенного вещества, что исключает возможность сопоставления значений их удельной электрической проводимости. По этой причине введено понятие молярной электрической проводимости
растворов разных концентраций содержатся различные количества растворенного вещества, что исключает возможность сопоставления значений их удельной электрической проводимости. По этой причине введено понятие молярной электрической проводимости
