Синергизм и антагонизм в смесях ПАВ (Ланге).
Синергизм в смесях ПАВ проявляется в улучшении свойств смеси (в сравнении с каждым из ПАВ в отдельности). Например, в получении эмульсий смесь двух ПАВ, используемых в качестве эмульгаторов, дает более стабильную эмульсию, чем эмульсии, полученные на каждом из ПАВ в отдельности. Другой пример — моющие средства, для производства которых применяются смеси анионных и неионогенных ПАВ. В данном случае неионогенное ПАВ предотвращает осаждение анионного, чувствительного к кальцию в жесткой воде. Моющие свойства таких продуктов значительно выше, чем у составов, содержащих лишь анионные или только неионогенные ПАВ. По параметру взаимодействия Р можно предсказать поведение бинарных систем ПАВ. Если Р отрицателен— ККМ смеси ПАВ ниже рассчитанной для идеальной смеси и отрицательные отклонения от идеальности приводят к проявлению синергетического эффекта.
Антагонизм смесей ПАВ предполагает снижение какого-либо поверхностно-активного свойства вследствие взаимодействия ПАВ в их смеси. Примером такого эффекта может быть поведение при мицеллобразовании в системах фторуглерод-углеводород. Очевидно, что ККМ такой системы выше рассчитанного значения для идеальной смеси. Параметр взаимодействия, рассчитанный по теории регулярных растворов, для такой смеси положителен.
МИЦЕЛЛЯРНЫЙ КАТАЛИЗ
Мицеллярный катализ - ускорение химических реакций в присутствии мицелл ПАВ. Данный процесс обусловлен главным образом изменением концентрации реагирующих веществ при переходе реагентов из раствора в мицеллы. Для реакций с участием диссоциирующих частиц существенно также влияние мицелл ПАВ на константу скорости и сдвиг равновесия диссоциации молекул реагентов. Наиболее корректное описание мицеллярного катализа дает псевдодвухфазная модель, которая рассматривает наблюдаемую скорость реакции как сумму скоростей процессов в фазе растворителя (воде или неводной среде в случае "обращенных" мицелл) и мицеллярной псевдофазе, характеризуемых соответственно константами скоростей kb и km. Распределение реагентов А, В, ... между мицеллами и растворителем описывается с помощью констант РА = [А]m/[А]b, PB = [В]т/[В]b, где [A] m- концентрация вещества в мицеллярной псевдофазе, [А]b- концентрация вещества в растворителе. Для наиболее распространенного случая бимолекулярной реакции типа А + В  продукты, наблюдаемая константа скорости второго порядка равна
продукты, наблюдаемая константа скорости второго порядка равна
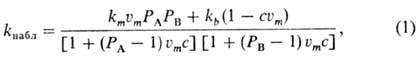
где um- молярный объем ПАВ, с - концентрация ПАВ в мицеллярной форме, т.е. общая концентрация ПАВ минус критическая концентрация мицеллообразования. Из уравнения (1) следует, что даже при отсутствии какого-либо влияния мицелл на константу скорости реакции (km = kb) они могут вызывать значительное ускорение вследствие концентрирования реагентов в мицеллярной псевдофазе при РА>> 1 и РB>>1. Напр., в случае ацилирования салицилальдоксима n-нитрофенило-вым эфиром триметилуксусной к-ты в присут. бромида цетилтриметиламмония (БЦТА) при рН 7,2 резкое увеличение скорости (см. рис.) происходит при достижении критич. концентрации мицеллообразования (ККМ) ПАВ, а затем kнабл проходит через максимум. Величина ускорения при оптимальной концентрации БЦТА-2.103 раз; константы Р для р-ции этого типа равны 102-103. Связывание реагентов с мицеллами для ионных веществ определяется величинами их гидрофобного и электростатического взаимодействия. Если один из реагентов связывается сильно, а другой распределен равномерно между обеими фазами (РА >> 1, РB = 1), то мицеллярный катализ проявляется только при условии km > kb. Это же условие необходимо для ускорения реакций первого порядка. Если один из реагентов преимущественно находится в мицеллярной псевдофазе, а другой в водной (РА>>1, РB<<1), то при km приблизительно равном kb будет наблюдаться ингибирование за счет разделения реагентов. Уравнение (1) не пригодно для описания кинетики быстрых реакций, происходящих за времена, близкие к временам жизни молекул реагентов внутри мицелл ПАВ, например тушения фотолюминесценции. Для этих систем развиты специальные подходы, учитывающие статистическое распределение молекул реагентов между мицеллами.
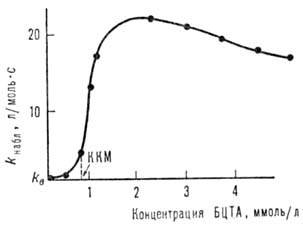
Зависимость kна6л от концентрации бромида цетилтриметиламмония (БЦТА) при ацилировании салицилальдоксима n-нитрофениловым эфиром триметилуксусной к-ты (kB = = 0,012 л/моль.с).
Мицеллярный катализ применяют для ускорения разнообразных химических реакций: эмульсионная полимеризация, идущая с участием молекул мономера, включенного в мицеллы ПАВ; нуклеофильное замещение замещение, например, гидролиз сложных и простых эфиров, амидов, шиффовых оснований; электронный перенос с участием органических и неорганических окислит.-восстановит. пар; замещение лиганда в комплексах металлов; фото- и радиационно-химические реакции и др. Важное самостоятельное направление - изучение каталитических функций ферментов, включенных в обращенные мицеллы ПАВ. Мицеллярный катализ исследуется также как модель ферментативного катализа. В этом отношении особенно перспективны так называемые функциональные мицеллы, образованные молекулами ПАВ с ковалентно связанными каталитически активными группами.
Лит.: Мицеллообразование, солюбилизация и микроэмульсии, под ред. К. Миттел, пер. с англ., М., 1980; Fendler J.H., Fendler E.J., Catalysis in miccllar and macromolecular systems, N.Y., 1975; Thomas J.K., "Chem. Rev.", 1980, v. 80, №4, p. 283-99; Turro N.J., Graetzel M., Braun A.M., "Angew. Chem., Intern. Ed.", 1980, v. 19, p. 675-96. A.K. Яцимирский.
