Физические свойства олефинов
1. Температура кипения олефинов немного ниже (на 5-15оС) температуры кипения соответственных предельных углеводородов. Увеличивается с возрастанием молекулярного веса. Олефины с углеродной цепью С2 – С4 – газ; С5 – С16 – жидкости; С17 и более – твердые вещества.
а. Ткип нормальных изомеров выше, чем разветвленных;
б. Ткип цис-изомеров выше, чем транс-изомеров;
в. Ткип увеличивается при перемещении двойной связи ближе к центру.
2. Температура плавления также зависит от строения. Она выше у транс-изомеров и увеличивается при перемещении двой ной связи ближе к центру.
3. Плотность олефинов несколько выше, чем у парафинов (т.к. больше относительное содержание более тяжелого углерода).
d204C5H12 = 0,626 d204C5H10 = 0,641
4. Олефины растворяются в воде незначительно, но лучше, чем парафины. Растворимость увеличивается с увеличением полярности углеводорода. Олефины хорошо растворяются в растворах солей тяжелых металлов, например, в растворе CuCl (вследствие комплексообразования).
5. Оптические свойства. Олефины имеют более высокий показатель преломления, что говорит об их более высокой поляризуемости.
6. Олефины дают избирательное поглощение в инфракрасной области (1670 – 1560 см-1 и 100 – 830 см-1). В УФ-области олефины дают поглощение при 180-200 нм.
Химические свойства олефинов
Химические свойства олефинов обусловлены природой двойных связей.
1) Двойная связь состоит из неравноценных связей: d-связи и p-связи. p-связь отличается от d-связи меньшей прочностью и большей поляризуемостью. Благодаря малой прочности p-связь легко разрывается. Этим обуславливается способность олефинов вступать в реакции присоединения.
2) В зависимости от характера реагента и условий проведения реакции могут идти или по гомолитическому, или по гетеролитическому механизму.
3) Благодаря легкой поляризуемости p-электронов и их способности захватывать положительные частицы. большинство реакций олефинов протекают по гетеролитическому электрофильному механизму.
Реакции присоединения
 1.Присоединение водорода происходит при действии молекулярного водорода СН2=СН2 + Н2 Ni, Pt, Pd СН3-СН3. Эта реакция гетерогенного катализа протекает на поверхности твердого катализатора. включает в себя три этапа:
1.Присоединение водорода происходит при действии молекулярного водорода СН2=СН2 + Н2 Ni, Pt, Pd СН3-СН3. Эта реакция гетерогенного катализа протекает на поверхности твердого катализатора. включает в себя три этапа:
1) адсорбция молекул из газовой фазы на поверхности катализатора;
2) взаимодействие молекул в адсорбированном состоянии;
3) десорбция продуктов реакции с поверхности катализатора.
Катализаторы – металлы: Fe, Co, Ni, Pt, Pd, имеющие d-уровни, не полностью заполненные электронами. за счет чего могут обраховываться донорно-акцепторные связи с олефинами; происходит хемосорбция олефинов на поверхности катализатора. Молекулы водорода тоже хемосорбируются с металлами в виде свободных атомов.




 Н СН2 СН2 Н
Н СН2 СН2 Н
| Ni |
Скорость реакций зависит от поверхности катализатора, величины его частиц, а также от количества активных центров на поверхности катализатора (которыми являются дефекты кристаллической решетки), на них начинаетя реакция. Скорость гидрирования олефинов зависит от разветвленности цепи. Чем больше заместителей. тем труднее протекает реакция (т.к. слабее адсорбция).
2.Присоединение галогенов.
F2 – присоединяется со взрывом;
Cl – на рассеянном свету или при низкой температуре в присутствии катализатора FeCl3;
Br2 – при комнатной температуре в полярных растворителях;
I – медленно в полярных растворителях.
Механизм реакций может быть и электрофильным, и свободнорадикальым.
Электрофильное присоединение происходит под действием полярных растворителей. Молекула галогена поляризуется Brd+ 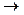 Brd- под действием Н2О. При взаимодействии ее с олефинами наблюдается последовательноеобразование p-комплекса и d-комплекса.
Brd- под действием Н2О. При взаимодействии ее с олефинами наблюдается последовательноеобразование p-комплекса и d-комплекса.
CH2=CH2 + Brd+ 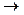 Brd-
Brd- 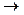 CH2=CH2
CH2=CH2 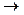 CH2-CH2 + Br
CH2-CH2 + Br 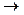 CH2-CH2
CH2-CH2
Brd+ 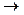 Brd- Br Br Br
Brd- Br Br Br
p-комплекс d-комплекс 1, 2-дибромэтан
p-комплекс образуется за счет захвата p-электронами положительного конца диполя молекулы галогена, затем образуется d-комплекс за счет обобщения атомом брома p-электронной пары с образованием d-связи. Одновременно происходит отщепление аниона брома. Затем карбокатион присоединяет анион брома. Таким образом, наблюдается ступенчатое присоединение двух атомов галогена.
Свободнорадикальное присоединение наблюдается при действии газообразного галогена в отсутствии растворителя на свету или при нагревании.
И: инициирование Cl2 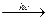 2Cl
2Cl
Ц: цепь CH2=CH2 + Cl.  CH2-CH2.
CH2-CH2.
Cl
CH2-CH2. + Cl2  CH2-CH2 + Cl.
CH2-CH2 + Cl.
Cl Cl Cl
О: обрыв цепи CH2-CH2. + Cl.  CH2-CH2
CH2-CH2
Cl Cl Cl
3.Присоединение галогеноводородов
Легкость присоединения возрастает от НСl HI, т.к. увеличивается поляризуемость молекул реагента. НF вызывает реакции полимеризации, его присоединение наблюдается только при назких темпратурах. Механизм реакций – электрофильный. HCl  H++ Cl-.
H++ Cl-.
Молекула олефина легко захватывает электрофильный реагент Н+ p-электронами (образуется p-комплекс), затем происходит образование
d-связи с Н+ за счет p-электронов (образуется d-комплекс),
CH2=CH2 + H+  CH2=CH2
CH2=CH2  CH3-CH2+
CH3-CH2+  CH3CH2Cl
CH3CH2Cl
H+
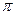 -комплекс
-комплекс 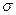 -комплекс хлористый этил
-комплекс хлористый этил
(карбкатион)
который стабилизируется за счет присоединения аниона хлора.
Если молекула содержит при ненасыщенном углероде какой-либо заместитель СН2=СН-Х, то место присоединения Н+ определяется природой заместителя. Все заместители делятся на две группы: электронодонорные (несущие избыток электронов и подающие их в цепь) и электроноакцепторные (имеющие недостаток электронов и притягивающие к себе p-электроны двойной связи).
Все углеводородные радикалы: СН3, С2Н5 и т.д. являются группами электронодонорными,
H
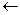 С
С 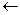 Н
Н
H
и отталкивают подвижные p-электроны двойной связи.
Например:
CH2 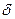 -=СН
-=СН 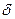 +
+ 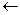 СН3
СН3
пропилен
В результате наиболее высокая электронная плотность создается у группы СН2; к ней и будет присоединяться протон.
CH2 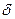 -=СН
-=СН 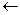 СH3 + H+
СH3 + H+  CH3-CH+-CH3
CH3-CH+-CH3 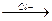 CH3-CH-CH3
CH3-CH-CH3
Cl
карбкатион хлористый изопропил
Таким образом, присоединение галогеноводородов к олефинам идет по правилу Марковникова: водород присоединяется к наиболее гидрированному атому углерода.
Эффект Караша
Присоединение галогеноводородов в присутствии примесей перекисей происходит не по правилу Марковникова. Причина – свободнорадикальный механизм реакции.
HO : OH  2HO
2HO
HO. + HBr  H2O + Br
H2O + Br
Br. + CH2=CH-CH3  CH2Br-CH.-CH3 (1)
CH2Br-CH.-CH3 (1)
CH2.-CHBr-CH3 (2)
Более устойчив (1) и образуется преимущественно, т.к. свободный электрон сопряжен с 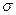 -электронами пяти С-Н связей.
-электронами пяти С-Н связей.
СH2Br-CH.-CH3 + HBr  CH2Br-CH2-CH3 + Br
CH2Br-CH2-CH3 + Br
Электрофильные реакции протекают через промежуточное образование карбкатионов, поэтому рассмотрим их свойства.
Свойства карбкатионов
1.Карбкатионы образуются в полярных средах под действием поляризованных реагентов по схемам:
R3C:H + Br+  HBr + R3C+
HBr + R3C+
CH2=CH2 + Br+  CH2+-CH2Br
CH2+-CH2Br
2.Устойчивость карбкатионов увеличивается от первичного к третичному
CH3  C+
C+ 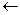 CH3 > CH3
CH3 > CH3  CH+
CH+ 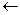 CH3 > CH3
CH3 > CH3  CH2+
CH2+
CH3
Причина – увеличение количества элетродонорных групп, окружающих заряженный атом углерода.
3.Химические превращения карбкатионов.
а) соединение с анионом: R+ + A-  RA
RA
б) отщепление протона (от наименее гидрированного из 2-х соседних звеньев:
CH3-C+-CH2-CH3  CH3-C=CH-CH3 + HA
CH3-C=CH-CH3 + HA
CH3 CH3
2-метил-2-бутен
в) присоединение к непредельному углеводороду:
R+ + CH2=CH2  R-CH2-CH2+
R-CH2-CH2+
Рассмотрим остальные химические свойства олефинов.
4.Присоединение Н2SO4 к олефинам происходит в соответствии с правило Марковникова, т.к. реагент очень полярный, и реакция всегда идет по ионному электрофильному механизму.
HOSO2OH 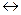 H+ + O-SO2OH
H+ + O-SO2OH
CH2 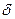 -=CH
-=CH 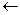 CH3 + H+
CH3 + H+  CH3
CH3  CH+
CH+ 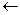 CH3
CH3  CH3-CH-CH3
CH3-CH-CH3
OSO2OH
более устойчив, чем первичный изопропиловый эфир
серной кислоты
Реакция присоединения Н2SO4 идет тем легче, чем больше радикалов окружает остаток этилена, т.е. чем больше электронная плотность у ненасыщенных атомов углерода.
 Так, СН2=СН2 (этилен) – присоединяет только концентрированную Н2SO4; СН2=СН-СН3 (пропилен) – присоединяет 78% кислоту; СН2=С-СН3 (изобутилен) – присоединяет 65% кислоту. СН3
Так, СН2=СН2 (этилен) – присоединяет только концентрированную Н2SO4; СН2=СН-СН3 (пропилен) – присоединяет 78% кислоту; СН2=С-СН3 (изобутилен) – присоединяет 65% кислоту. СН3
5.Присоединение воды требует катализатора и также происходит только в соответствии с правилом Марковникова.
СH2 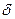 -=CH
-=CH 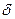 +
+  CH3 + H+OH
CH3 + H+OH  CH3-CHOH-CH3
CH3-CHOH-CH3
Пропилен ИПС
6.Гипогалоидирование – присоединение гипогалогентных кислот НОГал. (Гал2 в присутствии щелочи).
Cl : Cl + Na+OH-  NaCl + HO-Cl+ хлорноватистая кислота
NaCl + HO-Cl+ хлорноватистая кислота
 HO-Cl+ + CH3
HO-Cl+ + CH3  CH
CH 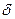 +=CH2
+=CH2 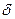 - CH3-CH-CH2
- CH3-CH-CH2
OH Cl
Пропиленхлоргидрин
Реакции окисления
Благодаря легкости разрыва p-связи олефины хорошо окисляются. Различаются следующие виды реакций окисления:
1.С разрывом только p-связи.
а) окисление по Вагнеру – действие разбавленного водного раствора KMnO4 при комнатной температуре – приводит к образованию гликолей
СH2=CH2 + O  CH2-CH2 + HOH
CH2-CH2 + HOH  CH2-CH2
CH2-CH2
(KMnO4) O OH OH
+H2O
окись этилена этиленгликоль
б) окисление надкислотами (реакция Прилежаева) приводит к образованию окисей.
O
СH2=CH2 + C6H5-C-O-OH  CH2-CH2 + C6H5C
CH2-CH2 + C6H5C
O O OH
надбензойная кислота бензойная кислота
2.Окисление с разрывом углеродной цепи происходит при действии сильных окислителей и при нагревании, например:
KMnO4 + H2SO4; продуктами реакций могут быть кетоны и карбоновые кислоты
O O
CH3-C=CH-CH3 + 3O 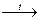 CH3-C + CH3-C
CH3-C + CH3-C
CH3 CH3 OH
2-метил-2-бутен
3.Озонирование – окисление озоном О3.
При действии озона сначала происходит его присоединение по двойной связи с образованием озонидов.
O-O-O O – O CH3
СH2=C-CH3 + O3  CH2-C-CH3
CH2-C-CH3  CH2 C
CH2 C
CH3 CH3 O CH3
Озониды разлагаются водой, давая альдегиды и кетоны, в зависимости от наличия заместителей
O-O-O O O
CH2-C-CH3 + H2O  H2O2 + CH2 + C-CH3
H2O2 + CH2 + C-CH3
CH3 CH3
По строению образующихся соединений можно легко установить местоположение двойной связи в олефине.
Реакции полимеризации
Это соединение нескольких или многих молекул в одну без изменения состава, происходящее за счет разрыва двойных связей. Существует два вида полимеризации олефинов:
1.Ступенчатая полимеризация – происходит в присутствии катализаторов (H2SO4, AlCl3), приводит к образованию димеров, тримеров, тетрамеров и т.д., причем на каждой стадии полученный продукт выделяется как устойчивое соединение. Реакция идет по механизму электрофильного присоединения
CH3  C=CH2
C=CH2 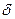 - + H+O-SO2OH
- + H+O-SO2OH  CH3-C+-CH3 + CH2
CH3-C+-CH3 + CH2 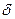 -=C
-=C  CH3
CH3 
CH3 конц. CH3 СH3
Изобутилен
СH3 CH3 CH3
 CH3-C-CH2-C+-CH3
CH3-C-CH2-C+-CH3  CH3-C-CH=C-CH3
CH3-C-CH=C-CH3 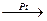 СH3-C-CH2-CH-CH3
СH3-C-CH2-CH-CH3
CH3 CH3 -H+ CH3 CH3 H2 CH3 CH3
Димер изобутилена изооктан
(октановое число принято за 100)
Образовавшийся димер может снова реагировать с катализатором и затем с олефином, в результате чего образуется тример и т.д. Используется для получения жидких высокооктановых углеводородов.
2.Цепная полимеризация протекает под действием инициаторов или катализаторов по цепному механизму. Низкомолекулярные продукты полимеризации не могут быть выделены, т.к. не фвляются устойчивыми веществами. Реакция приводит к образованию высокомолекулярных соединений.
nR1-CH=CH-R2  (-CH-CH-)n
(-CH-CH-)n
R1 R2
где n – степень полимеризации, которая составляет десятки и сотни тысяч. Исходное соединение носит название мономер. Высокомолекулярный продукт полимеризации – полимер. Полимеры низкого молекулярного веса (где n не более нескольких тысяч) называются олигомеры. Реакции цепной полимеризации могут протекать как по свободно-радикальному, так и по ионному механизму.
Примером свободно-радикальной полимеризации является получение оксиэтилена высокого давления (способ открыт в 1933 г.).
NCH2=CH2 + 0,1% O2  (-CH2-CH2-)n
(-CH2-CH2-)n
190-2100C
Кислород способствует инициированию реакции за счет образования перекисных радикалов. Если обозначить эти радикалы, инициирующие реакцию R, то механизм реакции будет выглядеть так:
R. + CH2=CH2  R-CH2-CH2.
R-CH2-CH2. 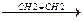 R-CH2-CH2-CH2-CH2.
R-CH2-CH2-CH2-CH2. 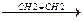
и т.д. до обрыва цепи
Ионная цепная полимеризация наблюдается в присутствии металлов. металлических катализаторов. катализаторов системы Циглера*. Пример – получение полиэтилена низкого давления.
NCH2=CH2  (-CH2-CH2-)n
(-CH2-CH2-)n
R=1-10 атм
T0=-70+150C
· Механизм действия катализатора Циглера. Полярная связь С-Al катализатора легко разрушается гетеролитически.
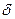 -
- 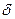 +
+
+CH2=CH
CH3
(С2Н5)Al+  C2-H5 + C
C2-H5 + C 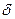 -H2=C
-H2=C 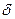 +H
+H  (C2H5)2Al+-CH2--CH-C2H5
(C2H5)2Al+-CH2--CH-C2H5 
CH3 CH3
 (C2H5)2Al-CH2-CH-CH2-CH-C2H5
(C2H5)2Al-CH2-CH-CH2-CH-C2H5
CH3 CH3
Полимеры, образованные в результате ионной полимеризации, отличаются правильным (регулярным) химическим и пространственным строением цепи и обладают большей кристалличностью, жесткостью и прочностью.
Все эти полимеры являются по существу предельными углеводородами чрезвычайного высокого молекулярного веса. Как и все предельные углеводороды, они устойчивы к окислителям. к действию концентрированных кислот и других агрессивных реагентов.
Теломеризация – разновидность цепной полимеризации, отличается тем, что процесс проводится с искусственным ранним обрывом цепи на стадии образования низкомолекулярных полимеров, содержащих 3-4 молекулы мономера. Состав продуктов теломеризации отличается от состава мономера, т.к. часть молекул растворителя, вызывающих обрыв цепи, входит в молекулу теломера. Например, теломеризация этилена в присутствии ССl4.
R. + CCl4  RCl + .CCl3 . CCl3 + CH2=CH2.
RCl + .CCl3 . CCl3 + CH2=CH2.  CCl3-CH2-CH2.
CCl3-CH2-CH2.
 CCl3-CH2-CH2-CH2-CH2.
CCl3-CH2-CH2-CH2-CH2. 
CCl3-CH2-CH2-CH2-CH2-CH2-CH2. 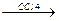 .CCl3 + CCl-(CH2-CH2)3-Cl
.CCl3 + CCl-(CH2-CH2)3-Cl
