Основные характеристики ковалентных связей
Полярность
Обуславливается различной электроотрицательностью соединя-ющихся атомов.
Величина электроотрицательности Х вычисляется как полусумма энергии сродства к электрону (энергии, выделяющейся при присоединении электрона к атому) и энергии ионизации (энергии, которая затрачивается для отрыва электрона от атома).
Х = ½ (Е + I)
Электроотрицательность характеризует способность атома притягивать к себе электронное облако связи. По шкале Полинга относительная величина электроотрицатеьности уменьшается в ряду:
| F | O | N | C | H | эл.вольт/ г-экв. |
| 4,0 | 3,5 | 3,0 | 2,5 | 2,1 |
Если разница в электроотрицательности 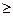 1,7, то общая электронная пара целиком переходит к более электроотрицательному атому и образуется ионная связь. При разнице <1,7 образуется связь ковалентная полярная.
1,7, то общая электронная пара целиком переходит к более электроотрицательному атому и образуется ионная связь. При разнице <1,7 образуется связь ковалентная полярная.
Область максимальной электронной плотности смещена к более электроотрицательному атому.
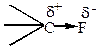
Если атомы имеют одинаковую электроотрицательность, и две части молекулы симметричны, то связь неполярная: СН3-СН3. Полярность связи может быть охарактеризована величиной дипольного момента связи, который можно рассматривать как произведение расстояния между центрами тяжести положительного и отрицательного заряда l на абсолютную величину сосредоточенного в этих центрах заряда е.
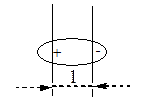
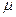 = l . e
= l . e
Полярность кратных связей в несколько раз выше, чем простых, т.к. p-электроны очень подвижны и смещаются сильнее, чем s-электроны. Из всех ковалентных связей наиболее полярными являются координационные.
Поляризуемость
Это способность электронного облака ковалентной связи деформироваться под действием внешних условий (полярного растворителя или реагента). Например:
d+ d- d+ d- d+ d-
 СН2=СН2 + Вr-Br СН2=СН2 …Вr-Вr
СН2=СН2 + Вr-Br СН2=СН2 …Вr-Вr
(бромная вода)
Вследствие смещения электронного облака к одному из атомов у него возникает дробный отрицательный заряд, а у другого такой же по величине дробный положительный заряд. Наиболее легко поляризуются кратные связи, благодаря высокой подвижности p -электронов.
Чем меньше электроотрицательность атома, тем он слабее удерживает электроны, тем легче поляризуется связь.
Например, поляризуемость связи
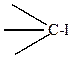
гораздо больше, чем связи
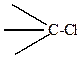
поэтому йодпроизводные легче дают реакции замещения галогена, чем хлорпроизводные, хотя полярность связи
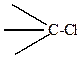
больше.
Направленность связей
При образовании связи перекрывание атомных орбиталей идет в направлении наибольшей вытянутости орбиталей, так как при этом меньше силы отталкивания. Направленность выражается величиной валентных углов. У насыщенного атома углерода валентные углы 109о28, при образовании двойной связи – 120о, при образовании тройной связи - 180о.
Длина связи
Длина связи может быть вычислена сложением ковалентных радиусов атомов. Ковалентный радиус меньше радиуса свободного атома, так как при образовании связи происходит "уплотнение" электронных облаков. Ковалентный радиус атома равен ½ длины его связи с другим таким же атомом. С увеличением кратности связи длина связи, а следовательно и ковалентный радиус, уменьшаются. Чем больше электронная плотность между ядрами, тем короче связь.
| длина простой связи | ºС-Сº | 1,54 А |
| длина двойной связи | =С=С= | 1,34 А |
| длина тройной связи | -СºС- | 1,20 А |
Энергия связи
Теплота, которая затрачена на образование молекулы, определяется экспериментально по энергии образования молекулы, т.к. энергия образования молекулы равна сумме энергий всех связей.
Например: ЕСН4 = 4ЕС-Н
Энергию образования молекулы метана можно определить по теплоте ее сгорания, разделив на 4. Получают энергию связи С-Н.
Связь между одинаковыми атомами часто бывает непрочной, особенно у атомов с высокой электроотрицательностью:
| Связь | CI-CI | N-N | O-O | S-S | Si-Si |
| Энергия связи, ккал/моль |
Связь С-С в отличие от них обладает исключительно высокой прочностью вследствие большей степени перекрывания гибридных орбиталей.
| Связь | C-C | С-Н | Si-O |
| Энергия связи, ккал/моль |
Прочность связи С-Н обусловлена отсутствием у водорода внутренних электронных оболочек, которые препятствовали бы приближению атомов углерода. Кроме того, атомы С и Н имеют относительно маленькие размеры, что обеспечивает большую плотность отрицательного заряда между их ядрами.
