Электролиты и неэлектролиты.
ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ
Вещества, проводящие в водном растворе электрический ток (соли, основания и кислоты), называются электролитами,не проводящие электрический ток – неэлектролитами. В связи с этим гипотеза ионизации после её экспериментального подтверждения получила название теории электролитической диссоциации.
Характер ионов, образующихся при диссоциации разных электролитов, должен быть различным. В солях диссоциация всегда приводит к образованию катионов металла и анионов кислотного остатка. Поэтому соли могут быть определены как соединения, дающие в водном растворе ионы металла и кислотного остатка:
NaNO3  Na+ + NO3–;
Na+ + NO3–;
К2SO4 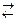 2К+ + SO42–.
2К+ + SO42–.
В основаниях из двух связей атома кислорода (с атомом элемента-металла и атомом водорода) значительно легче ионизируется первая. Поэтому при диссоциации образуются катионы металла, которые могут быть различными, и общие для всех оснований анионы гидроксогруппы (ОН–). Таким образом, основания – это соединения, дающие в водном растворе гидроксид-ионы. Число способных к ионизации гидроксогрупп определяет кислотность основания:
NaОН → Na+ + ОН– (однокислотное основание)
Ва(ОН)2 → Ва2+ + 2ОН– (двухкислотное основание,
диссоциация происходит
в две ступени)
Диссоциация кислот идёт с образованием катионов водорода и анионов кислотного остатка, которые могут быть различными. Общим для всех кислот признаком является образование в водном растворе ионов водорода. Кислоты – это соединения, дающие в водном растворе ионы водорода. Число способных к ионизации атомов водорода определяет основность кислоты:
НСl → Н+ + Сl– (одноосновная кислота);
Н2SO4 → 2Н+ + SO42– (двухосновная кислота,
диссоциация происходит
в две ступени).
Простейшим амфотерным соединением является вода, дающая при диссоциации ионы Н+ и ОН–. Однако диссоциация эта настолько мала, что концентрация как водородного иона, так и гидроксид-иона в чистой воде равна 10–7 моль/л.
Содержание ионов в воде с течением времени не изменяется. Отсюда следует, что наряду с ионизацией имеет место и обратный процесс – образование из ионов недиссоциированных молекул (моляризация). Подобная обратная реакция должна происходить и в растворе электролита: если ионы при своём беспорядочном движении столкнутся, то из них может образоваться молекула. Таким образом, электролитическая диссоциация есть процесс обратимый: в каждый данный момент за счёт ионизации молекул образуются ионы и за счёт столкновений ионов – молекулы. В результате устанавливается равновесие: за единицу времени будет образовываться столько же молекул, сколько распадаться. Например, для NaС1 это можно выразить схемой

В теории растворов подобные ионные молекулы NaCl (или правильнее Na+Cl-) часто называют ионными парами.
Количественную характеристику равновесного состояния электролита даёт его степень диссоциации, т. е. отношение числа молекул, распавшихся на ионы, к общему числу молекул в растворе. Для того чтобы эту величину выразить в процентах, нужно умножить её на 100.
Разбавление существенно не сказывается на скорости ионизации (на неё влияют лишь непосредственно окружающие молекулу электролита частицы воды, которых достаточно много не только в разбавленных растворах, но и в концентрированных), скорость моляризации при этом уменьшается (она зависит от числа столкновений между разноимёнными ионами, которое при разбавлении раствора становится меньше). В результате равновесие смещается вправо и степень диссоциации электролита при разбавлении раствора увеличивается. Следовательно, говоря о степени диссоциации электролитов, необходимо указывать и концентрацию растворов.
Электролиты, диссоциированные на 30 % и больше, называют сильными, диссоциированные в пределах от 30 до 3 %–электролитами средней силы, ещё менее диссоциированные – слабыми электролитами.
