Теория молекулярных орбиталей
Согласно теории молекулярных орбита‑лей, молекула состоит из ядер и электронов. В молекулах электроны находятся на молекулярных орбиталях (МО). МО внешних электронов имеют сложное строение и рассматриваются как линейная комбинация внешних орбиталей атомов, составляющих молекулу. Число образующихся МО равно числу АО, участвующих в их образовании. Энергии МО могут быть ниже (связывающие МО), равны (несвязывающие МО) или выше (разрыхляющие, антисвя‑зывающие МО), чем энергии образующих их АО.
Условия взаимодействия АО
1. АО взаимодействуют, если имеют близкие энергии.
2. АО взаимодействуют, если они перекрываются.
3. АО взаимодействуют, если имеют соответствующую симметрию.
Для двухатомной молекулы АВ (или любой линейной молекулы) симметрия МО может быть:
σ, если данная МО имеет ось симметрии,
π, если данная МО имеет плоскость симметрии,
δ, если МО имеет две перпендикулярные плоскости симметрии.
Присутствие электронов на связывающих МО стабилизирует систему, так как уменьшает энергию молекулы по сравнению с энергией атомов. Стабильность молекулы характеризуется порядком связи n, равным: n = (nсв – nразр)/2, где nсв и nразр – числа электронов на связывающих и разрыхляющих орбиталях.
Заполнение МО электронами происходит по тем же правилам, что и заполнение АО в атоме, а именно: правилу Паули (на МО не может быть более двух электронов), правилу Хунда (суммарный спин должен быть максимален) и т. д.
Взаимодействие 1s‑AO атомов первого периода (Н и Не) приводит к образованию связывающей σ‑МО и разрыхляющей σ*‑МО:
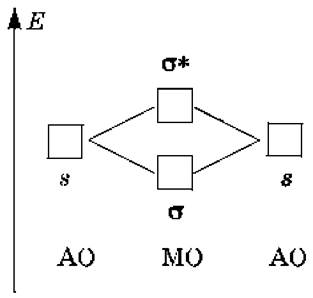
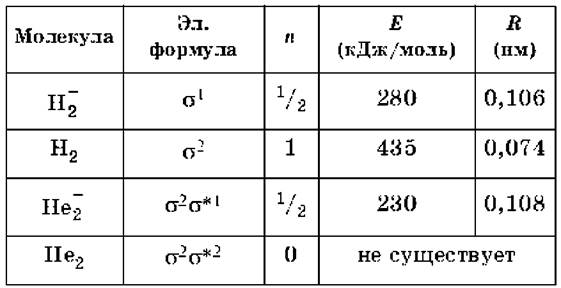
Электронные формулы молекул, порядки связей n, экспериментальные энергии связей Еи межмолекулярные расстояния Rдля двухатомных молекул из атомов первого периода приведены в следующей таблице:
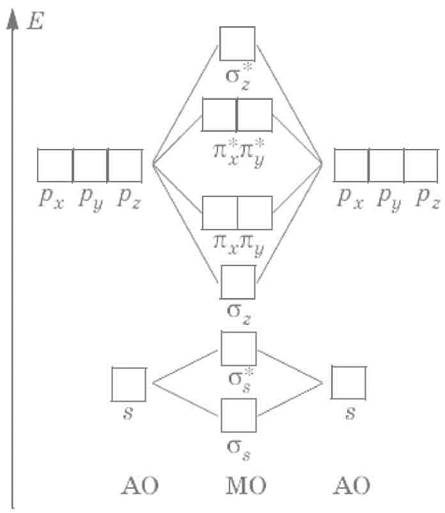
Другие атомы второго периода содержат, помимо 2s‑AO, также и 2рх‑, 2рy– и 2рz‑АО, которые при взаимодействии могут образовывать σ– и π‑MO. Для атомов О, F и Ne энергии 2s– и 2р‑АО существенно различаются, и можно пренебречь взаимодействием 2s‑AO одного атома и 2р‑АО другого атома, рассматривая взаимодействие между 2s‑AO двух атомов отдельно от взаимодействия их 2р‑АO. Схема МО для молекул O2, F2, Ne2 имеет следующий вид:
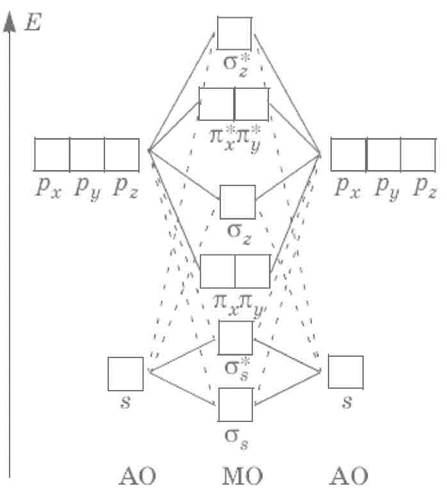
Для атомов В, С, N энергии 2s– и 2р‑АО близки по своим энергиям, и 2s‑AO одного атома взаимодействует с 2рz‑АО другого атома. Поэтому порядок МО в молекулах В2, С2 и N2 отличается от порядка МО в молекулах O2, F2 и Ne2. Ниже приведена схема МО для молекул В2, С2 и N2:
На основании приведенных схем МО можно, например, записать электронные формулы молекул O2, O2+и O2¯:
O2+(11ē)σs2σs*2σz2(πx2πy2)(πx*1πy*0)
n = 2 R = 0,121 нм;
O2(12ē)σs2σs*2σz2(πx2πy2)(πx*1πy*1)
n = 2,5 R = 0,112 нм;
O2¯(13ē)σs2σs*2σz2(πx2πy2)(πx*2πy*1)
n = 1,5 R = 0,126 нм.
В случае молекулы O2 теория МО позволяет предвидеть большую прочность этой молекулы, поскольку n =2, характер изменения энергий связи и межъядерных расстояний в ряду O2+– O2 – O2¯, а также парамагнетизм молекулы O2, на верхних МО которой имеются два неспаренных электрона.
Некоторые виды связей
Ионная связь – электростатическая связь между ионами противоположных зарядов. Ионная связь может рассматриваться как предельный случай ковалентной полярной связи. Ионная связь образуется, если разница электроотрицательностей атомов ΔХ больше чем 1,5–2,0.
Ионная связь является ненаправленной ненасыщаемойсвязью. В кристалле NaCl ион Na+притягивается всеми ионами Cl¯ и отталкивается всеми другими ионами Na+, независимо от направления взаимодействия и числа ионов. Это предопределяет большую устойчивость ионных кристаллов по сравнению с ионными молекулами.
Водородная связь– связь между атомом водорода одной молекулы и электроотрицательным атомом (F, CI, N) другой молекулы.
Существование водородной связи объясняет аномальные свойства воды: температура кипения воды гораздо выше, чем у ее химических аналогов: tкип(Н2O) = 100 °С, а tкип(H2S) = ‑61°C. Между молекулами H2S водородные связи не образуются.
