Электролиз расплавов и растворов
Электролизом называют процессы, протекающие под действием электрического тока на электродах, погруженных в расплав или раствор электролита. При электролизе происходит превращение электрической энергии в химическую.
При электролизе расплава соли или щелочи на катоде всегда восстанавливаются катионы металла, а на аноде окисляются анионы кислотного остатка (электролиз расплавов солей) или гидроксид – анионы (электролиз расплавов щелочей).
Пример 1. Составьте электронные уравнения процессов, происходящих на электродах при электролизе расплава щелочи гидроксида натрия.
Решение. При плавлении происходит термическая диссоциация щелочи:
NaOH ® Na+ + OH-
Под действием электрического тока происходит направленное движение ионов. На катоде будет идти восстановление катионов Na+, на аноде – окисление гидроксид –анионов:
(-) Катод Na+ OH- ® Анод (+)
Na+ + 1e ® Na 4ОН- - 4е ® 2Н2О + О2
 Суммарное уравнение:
Суммарное уравнение:
Na+ + 1ē ® Na 4
4ОН- - 4ē ® 2Н2О + О2 1
 4Na+ + 4OH- ® 4Na + 2H2O + O2
4Na+ + 4OH- ® 4Na + 2H2O + O2
Молекулярное уравнение:
4NaOH 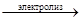 4Na + O2 + 2H2O
4Na + O2 + 2H2O
В водных растворах электролитов находятся гидратированные ионы растворенного вещества и молекулы воды. При электролизе растворов наряду с процессами восстановления катионов и окисления анионов вещества на электродах, могут восстанавливаться или окисляться и молекулы воды.
На катоде протекает процесс восстановления. В зависимости от величин стандартных электродных потенциалов металлов (табл. 6) возможны три варианта катодного процесса при электролизе.
1.Если соль образована катионами металлов, расположенными в раду стандартных электродных потенциалов от Li+ до Al3+ включительно, то на катоде происходит электрохимическое восстановление молекул воды с выделением водорода:
2Н2О + 2ē ® Н2 + 2ОН-
2.Если соль образована катионами металлов, расположенными в ряду стандартных электродных потенциалов после водорода, на катоде восстанавливаются катионы этих металлов:
Меn+ + nē ® Ме
3.Если соль образована катионами металлов, расположенными в ряду стандартных электродных потенциалов после Al3+ до водорода, то на катоде восстанавливаются катионы металлов одновременно с молекулами воды:
Меn+ + nē ® Ме
2Н2О + 2ē ® Н2 + 2ОН-
На аноде протекает процесс окисления. Характер реакций, протекающих на аноде, зависит от природы электролита, присутствия молекул воды и материала анода. Аноды подразделяются на нерастворимые и растворимые.
В случае нерастворимых (инертных) анодов возможны два варианта анодного процесса при электролизе.
1.Если соль образована бескислородной кислотой (кроме фторидов), то на аноде окисляются анионы этих кислот, например:
2J- - 2ē ® J2
или S2- - 2ē ® S
2.Если соль образована кислородсодержащей кислотой, то на аноде окисляются молекулы воды с выделением О2:
2Н2О – 4ē ® О2 + 4Н+
Если электролизу подвергается раствор щелочи, то на аноде будут окисляться гидроксид – ионы:
4ОН- - 4ē ® О2 + 2Н2О
В случае растворимых (активных) анодов сам анод подвергается окислению:
Ме Û Меn+ + nē
металл уходят уходят
анода в раствор во внешнюю цепь
Образующиеся катионы переходят в раствор, анод при этом растворяется.
Пример 2. Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора хлорида натрия NaCl с нерастворимым анодом.
Решение. Натрий располагается в начале ряда стандартных электродных потенциалов до алюминия и на катоде будут восстанавливаться молекулы воды. На аноде будут окисляться хлорид – ионы, так как это анионы бескислородной кислоты:
NaCl ® Na+ + Cl-
(-) Катод Na+ Cl- ® Анод (+)
Н2О
2Н2О + 2ē ® Н2 + 2ОН- 2Cl- -2ē ® Cl2
Суммарное уравнение:
2Н2О + 2ē ® Н2 + 2ОН-
 2Cl- -2ē ® Cl2
2Cl- -2ē ® Cl2
2Н2О + 2Cl- ® Н2 + 2ОН- + Cl2
В прикатодном пространстве накапливаются катионы Na+ и анионы ОН-, образуя щелочь NaOH.
Молекулярное уравнение:
2NaCl + 2H2O 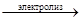 H2 + Cl2 + 2NaOH
H2 + Cl2 + 2NaOH
катод анод в прикатодном
пространстве
Пример 3. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора Ag2SO4. Сколько граммов серебра выделится на катоде при электролизе раствора Ag2SO4 в течение 60 минут при силе тока 4А? Чему равен объем газа, выделившегося на аноде?
Решение. Серебро располагается в ряду стандартных электродных потенциалов после водорода, следовательно, на катоде будет идти восстановление катионов серебра. На аноде идет окисление молекул воды с выделением кислорода, т.к. соль образована кислородосодержащей кислотой.
Ag2SO4 ® 2 Ag+ + SO42-
(-) Катод 2 Ag+ SO42- ® Анод (+)
Н2О
2Ag+ + 2ē ® 2Ag 2H2O - 4ē ® O2 + 4H+
В прианодном пространстве накапливаются ионы SO42- и Н+, образуя кислоту Н2SO4.
Суммарное уравнение:
 2Ag+ + 2ē = 2Ag 2
2Ag+ + 2ē = 2Ag 2
2H2O - 4ē = O2 + 4H+ 1
 4Ag+ + 2H2O = 4Ag + O2 + 4H+
4Ag+ + 2H2O = 4Ag + O2 + 4H+
или
2Ag2SO4 + 2Н2О 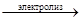 4Ag + О2 + 2Н2SO4
4Ag + О2 + 2Н2SO4
катод анод в прианодном
пространстве
По законам Фарадея масса выделившихся на электродах веществ (m) определяется по формуле:
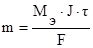 ,
,
где Мэ – молярная масса эквивалента вещества, г/моль;
J – сила тока, А;
t - продолжительность электролиза, с;
F – число Фарадея (96500 Кл).
Молярная масса эквивалента серебра в Ag2SO4 равна отношению молярной массы серебра к его валентности:
Мэ(Ag) = МAg/1 = 107,87 г/моль.
Подставив в формулу значения Мэ(Ag) = 107,87 г/моль, J = 4А,
t = 60 × 60 = 3600 с, получим:
 .
.
При определении объемов выделившихся газов закон Фарадея имеет вид:
 ,
,
где V – объем выделившегося газа, л;
Vэ – молярный объем эквивалента газа, л.
Молярная масса кислорода М 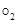 = 32 г/моль, молярная масса эквивалента кислорода М
= 32 г/моль, молярная масса эквивалента кислорода М 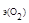 = 8 г/моль. Молярный объем эквивалента кислорода рассчитываем, исходя из следствия закона Авогадро:
= 8 г/моль. Молярный объем эквивалента кислорода рассчитываем, исходя из следствия закона Авогадро:
32 г кислорода при н.у. занимают объем 22,4 л
8 г кислорода при н.у. занимают объем х л (Vэ)
 , тогда объем кислорода, выделившегося на аноде, будет равен:
, тогда объем кислорода, выделившегося на аноде, будет равен:
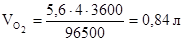 .
.
Пример 4. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора Ni(NO3)2. Вычислите продолжительность электролиза, если при силе тока 3А на катоде выделилось 5,8 г никеля.
Решение. Никель располагается в ряду стандартных электродных потенциалов после алюминия, но до водорода. На катоде будет происходить восстановление катионов никеля, а также молекул воды с выделением водорода. На аноде идет окисление молекул воды с выделением кислорода.
Ni(NO3)2 ® Ni2+ + 2NO3-
(-) Катод Ni2+ 2NO3- ® Анод (+)
Н2О
Ni2+ + 2ē ® Ni0
2Н2О + 2ē ® Н20 + 2ОН- 2Н2О - 4ē ® О2 + 4Н+
В прианодном пространстве накапливаются ионы NO3- и Н+, образуя кислоту НNO3.
Суммарное уравнение
Ni2+ + 2ē ® Ni0


 2Н2О + 2ē ® Н20 + 2ОН-
2Н2О + 2ē ® Н20 + 2ОН-
2Н2О - 4ē ® О2 + 4Н+ ® 2Н2О + 2Н+
 | |||
 |
Ni2+ +2Н2О = Ni + Н2 + О2 + 2Н+
или
Ni(NO3)2 + 2Н2О 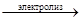 Ni + Н2 + О2 + 2НNO3
Ni + Н2 + О2 + 2НNO3
катод анод в прианодном
пространстве
Для вычисления времени электролиза используем математическое выражение законов Фарадея:
 .
.
Молярная масса эквивалента никеля в Ni(NO3)2 равна отношению молярной массы никеля к его валентности: Мэ(Ni) = 58,71/2 = 29,35 г/моль.
Продолжительность электролиза:
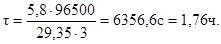
Пример 5.На сколько граммов уменьшится масса висмутового анода, если электролиз раствора BiCl3 проходит при силе тока 2А в течение
40 минут? Составьте схему электролиза.
Решение. Процесс электролиза с растворимым анодом сводится к окислению атомов материала анода и восстановлению на катоде катионов висмута из раствора, т.е. к переносу висмута с анода на катод. Анод растворяется, при этом количество ионов висмута Bi3+ в растворе остается неизменным.
BiCl3 ® Bi3+ + 3Cl-
(-) Катод Bi3+ 3Cl- ® Анод (+)
висмутовый

 Bi3+ + 3ē ® Bi0 Bi0 - 3ē ® Bi3+
Bi3+ + 3ē ® Bi0 Bi0 - 3ē ® Bi3+
 |
Процесс будет продолжаться до полного растворения анода.
По законам Фарадея рассчитаем массу выделившегося на катоде висмута:
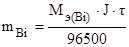 , где J = 2А, t = 40 × 60 = 2400 с.
, где J = 2А, t = 40 × 60 = 2400 с.
Молярная масса эквивалента висмута в BiCl3 равна отношению молярной массы висмута к его валентности:
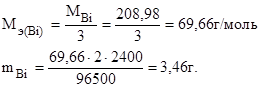
Следовательно, масса висмутового анода уменьшилась на 3,46 г.
ЗАДАНИЯ
261.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН и расплава КОН. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора КОН в течение 1ч при силе тока 6А.
262.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов CuSO4 и КJ. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора CuSO4 в течение 30 мин при силе тока 4А.
263.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов Na2SO4 и HgCl2. Сколько граммов воды разлагается при электролизе раствора Na2SO4 при силе тока 7А в течение 5 ч?
264.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов К2SO4 и CuCl2. Вычислите объем выделившихся на электродах веществ, если электролиз К2SO4 проводили при силе тока 5А в течение 3ч.
265.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgCl2 и NiSO4. Вычислите продолжительность электролиза раствора NiSO4 в минутах, если при силе тока 8А на катоде выделилось 1,8г никеля.
266.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора CuCl2: а) если анод медный; б) если анод инертный. Вычислите количество выделившейся меди на катоде, если электролиз CuCl2 с инертным анодом проводили в течение 5 часов при силе тока 5А.
267.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов CuSO4 и КCl. Вычислите, сколько граммов меди выделилось на катоде, если при электролизе раствора CuSO4 на аноде выделилось 168 мл кислорода, измеренного при н.у.
268.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов Zn(NO3)2 и NaBr. Вычислите силу тока, если электролиз раствора нитрата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода, измеренного при н.у.
269.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора ZnSO4: а) в случае инертного анода; б) в случае цинкового анода. Вычислите, на сколько граммов уменьшится масса цинкового анода, если электролиз раствора ZnSO4 происходит при силе тока 2А в течение 40 мин.
270.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов NaJ и CdSO4. Вычислите, какие вещества и в каком количестве выделятся при электролизе раствора NaJ в течение 2,5 ч, если сила тока равна 6А.
271.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора NiCl2, если анод сделан из никеля, и раствора AgNO3, если анод инертный. Как изменится масса никелевого анода после пропускания тока силой 3,2А в течение 30 мин?
272.Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе расплава NaCl и водного раствора NaCl. Сколько литров (н.у.) газа выделится на аноде при электролизе раствора хлорида натрия, если электролиз проводить в течение 30 мин при силе тока 0,5А?
273.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgSO4 и ZnCl2. Вычислите силу тока при электролизе раствора MgSO4 в течение 1 ч 40 мин, если на катоде выделилось 1,4 л водорода (н.у.).
274.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом; с растворимым - серебряным анодом. Вычислите массу серебра и объем кислорода, выделившихся на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом, если время электролиза 50 мин, сила тока 2А.
275.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водных растворов CdCl2 и Na2CO3. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора карбоната натрия в течение 180 мин при силе тока 5А.
276.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водных растворов KNO3 и CuBr2. Электролиз раствора KNO3 проводили в течение 5 ч при силе тока 7А. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде.
277.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов KBr и Hg(NO3)2. Какие вещества и в каком количестве выделяются на инертных электродах при электролизе водного раствора KBr в течение 1 ч 35 мин при силе тока 15 А?
278.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора KCl и расплава KCl. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора KCl в течение 60 мин при силе тока 5 А.
279.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водных растворов AgNO3 и FeCl2. Электролиз раствора AgNO3 проводили при силе тока 2 А в течение 4 часов. Сколько граммов серебра выделилось на катоде?
280.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора FeSO4, с нерастворимым анодом и с растворимым – железным анодом. Вычислите продолжительность (в мин) электролиза раствора FeSO4 с нерастворимым анодом при силе тока 10А, если на катоде выделилось 6,8 г железа.
Коррозия металлов
Коррозией называется самопроизвольное разрушение металлов и сплавов в результате химического взаимодействия их с окружающей средой.
В зависимости от механизма протекания коррозийного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия протекает при взаимодействии металлов с сухими газами или растворами неэлектролитов. Электрохимическая коррозия протекает в водных растворах электролитов и во влажной атмосфере.
При электрохимической коррозии происходит образование местных гальванических пар. Участки с более отрицательным потенциалом являются анодными, а с более положительным – катодными. На анодных участках происходит окисление металла Ме0 – nē ® Меn+, на катодных – восстановление окислителя. Если коррозия происходит в кислой среде, то на катоде восстанавливаются ионы водорода: 2Н+ + 2ē ® Н2 (водородная деполяризация). Если коррозия происходит во влажном воздухе (атмосферная коррозия), в электролите, содержащем растворенный кислород, при неравномерной аэрации, то на катоде восстанавливаются молекулы кислорода: О2 + 2Н2О + 4ē ® 4ОН- или О2 + 4Н+ + 4ē ® 2Н2О (кислородная деполяризация).
Коррозия при неравномерной аэрации наблюдается, когда доступ растворенного кислорода к различным частям изделия неодинаков. При этом те части металла, доступ кислорода к которым минимален, являются анодными участками. Это объясняется тем, что на катодных участках, где доступ кислорода больше, вследствие восстановления кислорода
(О2 + 2Н2О + 4ē ® 4ОН-) происходит подщелачивание и металлы (в частности железо) пассивируются. На неаэрируемых участках происходит окисление металла: Ме0 – nē ® Меn+.
Пример 1. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если пара металлов находится в кислой среде (в H2SO4). Составьте схему образующегося при этом гальванического элемента, напишите уравнения электродных процессов.
Решение. Сравнивая величины стандартных электродных потенциалов (табл. 6), видим, что хром является более активным металлом (  ) и в образующейся гальванической паре будет анодом. Медь является катодом (
) и в образующейся гальванической паре будет анодом. Медь является катодом ( 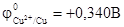 ), как менее активный металл. В кислой среде схема образующегося гальванического элемента будет следующая:
), как менее активный металл. В кислой среде схема образующегося гальванического элемента будет следующая:
А (-) Cr ½ H2SO4½ Cu (+) K
Электронные уравнения электродных процессов:
А: Cr0 - 3ē ® Cr3+
К: 2H+ +2ē ® H2
Хром окисляется. На катоде восстанавливаются ионы водорода (водородная деполяризация).
Пример 2. Как происходит коррозия во влажном воздухе пары олово-висмут? Составьте схему образующегося гальванического элемента, напишите электронные уравнения электродных процессов.
Решение. Во влажном воздухе происходит атмосферная коррозия. При этом поверхность металла, находящегося во влажном воздухе, покрывается пленкой воды, содержащей различные газы, и в первую очередь кислород. Стандартный электродный потенциал олова 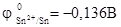 , а стандартный электродный потенциал висмута
, а стандартный электродный потенциал висмута 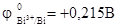 . Потенциал висмута более положительный, следовательно, при контакте этих металлов олово будет анодом, а висмут – катодом. Схема образующегося при атмосферной коррозии гальванического элемента будет следующая:
. Потенциал висмута более положительный, следовательно, при контакте этих металлов олово будет анодом, а висмут – катодом. Схема образующегося при атмосферной коррозии гальванического элемента будет следующая:
А (-) Sn ½ H2O, O2½ Bi (+) K
Электронные уравнения электродных процессов:
 А: Sn0 - 2ē ® Sn2+ 2
А: Sn0 - 2ē ® Sn2+ 2
K: O2 + 2H2O + 4ē ® 4OH- 1
Уравнивая число электронов, участвующих в катодном и анодном процессах, можно записать суммарное уравнение:
2Sn  +O2 + 2H2O ® 2Sn2+ + 4OH-
+O2 + 2H2O ® 2Sn2+ + 4OH-
Ионы Sn2+ взаимодействуют с гидроксид-ионами:
Sn2+ + 2ОH- ® Sn(ОН)2.
Образующийся гидроксид Sn(ОН)2 является продуктом коррозии.
ЗАДАНИЯ
281.Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении целостности покрытия? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
282.Цинк покрытый серебром. Какое это покрытие – анодное или катодное? Почему? Какой из металлов будет корродировать во влажном воздухе в случае разрушения покрытия? Составьте электронные уравнения анодного и катодного процессов? Каков состав продуктов коррозии?
283.В раствор соляной кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Дайте этому объяснение, составьте электронные уравнения анодного и катодного процессов.
284.Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в сильнокислой среде.
285.Какое покрытие металла называется анодным и какое катодным? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью во влажном воздухе и в сильнокислой среде.
286.Железное изделие покрыли кадмием. Какое это покрытие анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной кислоте.
287.Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
288.Как происходит коррозия железного изделия, покрытого титаном, находящегося во влажном грунте, содержащем растворенный кислород? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
289.Две цинковые пластинки, частично покрытые одна никелем, другая – серебром, находятся во влажном воздухе. На какой из пластинок коррозия протекает интенсивнее? Почему? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
290.В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
291.Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
292.Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
293.Определите, какой металл является анодом, а какой катодом в паре алюминий – железо. Что происходит на пластинках при атмосферной коррозии и коррозии в кислой среде? Составьте электронные уравнения анодного и катодного процессов.
294.Как происходит атмосферная коррозии пар Cd-Sn и Sn-Cu при нарушении целостности покрытия? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
295.В раствор соляной кислоты опустили пластинку из кобальта и кобальтовую пластинку, частично покрытую хромом. В каком случае процесс коррозии кобальта происходит интенсивнее? Почему? Составьте электронные уравнения анодного и катодного процессов.
296.Как происходит коррозия никелированного и хромированного железа во влажном воздухе? Составьте электронные уравнения анодного и катодного процессов коррозии в обоих случаях.
297.Если на стальной предмет нанести каплю воды, то вследствие неравномерной аэрации коррозии подвергается средняя, а не внешняя часть смоченного металла. После высыхания капли в ее центре появляется пятно ржавчины. Чем это можно объяснить? Какой участок металла, находящийся под каплей воды, является анодным и какой катодным? Составьте электронные уравнения соответствующих процессов.
298.Если гвоздь вбить во влажное дерево, то вследствие неравномерной аэрации ржавчиной покрывается та его часть, которая находится внутри дерева. Чем это можно объяснить? Анодом или катодом является эта часть гвоздя? Составьте электронные уравнения соответствующих процессов.
299.Две цинковые пластинки частично покрытые одна никелем, другая серебром, находятся во влажном воздухе. На какой из пластинок коррозия протекает интенсивнее? Почему? Составьте электронные уравнения анодного и катодного процессов.
300.В чем заключается сходство и различие между анодным покрытием и протекторной защитой? Приведите пример протекторной защиты хрома в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Комплексные соединения
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так в и кристалле, называют комплексными. При образовании комплексных соединений наблюдается взаимная координация взаимодействующих частиц, так называемое комплексообразование. Образующиеся сложные по составу частицы называются комплексными.
Например: Fe(CN)3 + 3KCN = K3[Fe(CN)6]
Ni(OH)2 + 6NH3 = [Ni(NH3)6](OH)2
В структуре комплексного соединения различают внутреннюю (координационную) и внешнюю сферы. Центральное место во внутренней сфере занимает комплексообразователь (чаще всего это ион металла
d– лемента). Вокруг комплексообразователя на близком расстоянии расположены (координированы) отрицательно заряженные ионы или нейтральные молекулы – лиганды. Число лигандов, координированных около комплексообразователя, называют координационным числом. При записи комплексного соединения внутреннюю сферу заключают в квадратные скобки. На более далеком расстоянии от комплексообразователя располагаются ионы внешней сферы. Например, K3[Fe(СN)6]: комплексообразователь – Fe3+, лиганды – ионы CN-, координационное число – 6, [Fe(СN)6]3- - внутренняя сфера, 3К+ - внешняя сфера.
Заряд комплексного иона равен алгебраической сумме заряда комплексообразователя и зарядов лигандов.
В зависимости от заряда различают анионные комплексы, например, [Fe(СN)6]3-, [Al(OH)4]-; катионные комплексы, например, [Ni(NH3)6]2+, [Cr(H2O)4Cl2]1+; нейтральные комплексы, например, [Pt(NH3)2Cl2], [Cr(H2O)3F3]. Нейтральные комплексы не имеют внешней сферы.
В водных растворах комплексные соединения, проявляя свойства электролитов, диссоциируют на комплексный ион и ионы внешней сферы (первичная диссоциация):
K3[Fe(СN)6] ® 3К+ + [Fe(СN)6]3- (1)
Равновесие процесса первичной диссоциации (1) характеризуется константой диссоциации:
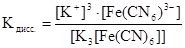
Образовавшийся комплексный ион в незначительной степени может подвергаться вторичной диссоциации, образуя составляющие его частицы (ионы, молекулы):
[Fe(СN)6]3- Û Fe3+ + 6CN- (2)
Равновесие процесса (2) характеризуется константой нестойкости:

Чем меньше константа нестойкости, тем более устойчив данный комплексный ион. Нейтральные комплексы электролитами не являются.
Существуют комплексные соединения с малоустойчивой внутренней сферой, которые распадаются в водном растворе на все составляющие ионы. Такие комплексные соединения называются двойными солями. Например,
KAl(SO4)2 ®K+ + Al3+ + 2SO42-
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях:
а) K4[Fe(CN)6]; б) [Cr(H2O)2(NH3)3Cl]Cl2.
Решение. Заряд комплексного иона можно рассчитать по заряду внешней сферы, так как он равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него.
Степень окисления комплексообразователя определяется, исходя из того, что алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю. Заряды кислотных остатков определяют из формул соответствующих кислот.
а) K4[Fe(CN)6]
Заряд внешней сферы (4К+): (+1)×4 = 4+. Следовательно, заряд комплексного иона равен (4-): [Fe(CN)6]4-. Координационное число – число лигандов – равно 6. Степень окисления комплексообразователя (Fe+х) равна:
(+1)×4 + х + (-1)×6 = 0. Отсюда х = +2, (Fe+2)
Степень окисления комплексообразователя можно рассчитать и по заряду комплексного иона [Fex(CN)6]4-: х+ (-1)×6 = -4; х = +2 (Fe+2)
б) [Cr(H2O)2(NH3)3Cl]Cl2
Заряд внешней сферы (2Cl-) равен (2-). Следовательно, заряд комплексного иона равен (2+): [Cr (H2O) 2(NH3) 3Cl]2+. Координационное число (число лигандов) равно (2 + 3 +1) = 6. Степень окисления комплексообразователя (Cr+х) равна:
х + 0×2 + 0×3 + (-1)×1 + (-1)×2 = 0 х – 1 -2 = 0; х = +3 (Cr+3)
или [Crх(H2O)02(NH3)03Cl-1]2+ х + 0×2 + 0×3 + (-1) = +2; х = +3 (Cr+3)
Пример 2. составьте координационную формулу комплексного соединения по следующим данным: а) Co(NO2)3×2KCl×NH3; комплексообразователь – кобальт; координационное число равно 6; б) CrCl3×H2O×3NH3; комплексообразователь – хром; координационное число равно 6.
Решение.
а) В набор данных соединений Co(NO2)3×2KCl×NH3 входят 2 молекулы KCl, где К – щелочной металл (s – элемент), а комплексообразователями в основном выступают атомы d – элементов (в данном примере - кобальт). Следовательно, катионы калия будут образовывать внешнюю сферу и таким образом комплексный ион будет анионом. Во внутреннюю сферу комплексного аниона будут входить одна молекула NH3, три иона NO2- и два иона Cl-. Координационное число (число лигандов) равно (1+3+2)=6. Координационная формула комплексного соединения имеет вид: K2[Co(NH3)(NO2)3Cl2].
б) В наборе данных соединений CrCl3×H2O×3NH3 комплексообразователем является ион Cr3+. Координационное число равно 6. Исходя из того, что нейтральные молекулы в большинстве случаев входят во внутреннюю сферу комплексного соединения, то в данном примере внутреннюю сферу составят три молекулы NH3, одна молекула H2O, два иона Cl-. Третий хлорид-ион (Cl-) образует внешнюю сферу. Следовательно, комплексный ион будет катионом. Координационная формула комплексного соединения имеет вид: [Cr(NH3)3H2OCl2]Cl.
ЗАДАНИЯ
301.Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, K2[PtCl6], K[Ag(CN)2]. Напишите уравнения диссоциации в водном растворе комплексного соединения [Cu(NH3)4]SO4 и выражение для константы диссоциации и константы нестойкости.
302.Составьте координационные формулы следующих комплексных соединений по следующим данным:
а) исходные соединения PtCl4 ×2H2O; к.ч. = 6; б) исходные соединения Cr(NO3)3×2NH3×4H2O; к.ч. = 6. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
303.Составьте координационные формулы следующих комплексных соединений по следующим данным: а) исходные соединения KCl×СrCl3×2H2O; к.ч. = 6
б) исходные соединения СоCl3×H2O×4NH3; к.ч. = 6. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
304.Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях Na[Ag(NO2)2], [Zn(NH3)4]SO4, K[SbBr6]. Напишите уравнения диссоциации в водном растворе комплексного соединения Na[Ag(NO2)2] и выражения для константы диссоциации и константы нестойкости.
305. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K3[Au(CN)2Br2], [Ni(NH3)6](NO3)2, K2[PtCl(OH)5]. Напишите уравнения диссоциации в водном растворе комплексного соединения K3[Au(CN)2Br2] и выражения для константы диссоциации и константы нестойкости.
306. Составьте координационные формулы комплексных соединений по следующим данным: а) исходные соединения AgCl×2NH3; к.ч. = 2;
б) исходные соединения 2NaOH×Pt(NO2)2; к.ч. = 4. Для одного из полученных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
307. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K4[Fe(CN)6], [Co(NH3)5Cl]SO4, K2[HgI4]. Напишите уравнения диссоциации в водном растворе комплексного соединения K2[HgI4] и выражения для константы диссоциации и константы нестойкости.
308. Определите, чему равен заряд следующих комплексных ионов [Cr(H2O)4Cl2]x, [HgBr4]x, [Fe(CN)6]x, если комплексообразователями являются Cr3+, Hg2+, Fe3+. Напишите координационные формулы соединений, содержащих эти комплексные ионы. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
309.Определите, чему равен заряд комплексных ионов [Cr(NH3)5NO2]x, [Pd(NH3)Cl3]x, [Ni(CN)4]x, если комплексообразователями являются Cr3+, Pd2+, Ni2+. Напишите координационные формулы соединений, содержащих эти комплексные соединения. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
310. Составьте координационные формулы комплексных соединений по следующим данным: а) исходные соединения 2KCN×Pd(CN)2; к.ч. = 4; б) исходные соединения Сr(NO2)3×5NH3; к.ч. = 6. Для одного из полученных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
311. Составьте координационные формулы комплексных соединений по следующим данным: а) исходные соединения 3NaCN×Fe(CN)2×NH3; к.ч. = 6; б) исходные соединения CoBr3×4NH3×2H2O; к.ч. = 6. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
312.Напишите уравнения вторичной диссоциации и выражения для констант нестойкости комплексных ионов: [Ag(NH3)2]+, [Fe(CN)6]4- Наши рекомендации
