Загрязнение воздушной среды
Соединениями серы
Основные поступления неорганических соединений серы в тропосферу связаны с антропогенными источниками. На их долю приходится примерно 65% всех поступлений неорганических соединений серы в атмосферу. Около 95% из этого количества составляет диоксид серы.
Из природных источников поступления неорганических соединений серы следует выделить волновую деятельность в океанах, приводящую к образованию аэрозолей. Общее количество серы, содержащейся в аэрозолях в виде сульфатов магния и кальция, оценивается в 44 млн т в год, что составляет примерно 30% от ее поступления в атмосферу в виде неорганических соединений.
Биологические источники неорганических соединений серы выделяют преимущественно сероводород, с которым в атмосферу поступает по различным оценкам от 23 до 49% всех неорганических соединений серы. Масштабы поступления сероводорода в атмосферу и процессы его трансформации в атмосфере изучены еще недостаточно подробно. Имеющиеся в литературе сведения позволяют лишь грубо оценить его содержание в тропосфере. Так, над океанами концентрация H2S колеблется от 0,0076 до 0,076 мкг/м3, а над континентами — от 0,05 до 0,1 мкг/м3. Принимая во внимание скорость поступления сероводорода в атмосферу и его содержание в тропосфере, можно оценить время его жизни в атмосфере в несколько часов.
Как уже отмечалось выше, в тропосфере происходят процессы окисления соединений серы, основным окислителем в которых выступают свободные радикалы. Сероводород, например, последовательно, в ряде стадий окисляется до SO2. Детальный механизм этого процесса еще не установлен. Наиболее вероятным представляется протекание следующих реакций:
H2S + ·ОН ® Н20 + HS·
HS· + 02 ® SO + ·ОН
SO + Н02· ® S02 + ·ОН
Полученный в результате диоксид серы, как и S02, поступающий из других источников, окисляется далее. Механизм этого процесса изучен более подробно.
Окисление диоксида серы может протекать в газовой фазе — первый путь, в твердой фазе (окислению предшествует адсорбция) — второй путь и в жидкой фазе (окислению предшествует абсорбция) — третий путь.
Газофазное окисление (первый путь) исторически является первой попыткой объяснить процессы окисления диоксида серы в атмосфере. Долгие годы основной механизм процесса связывали с образованием диоксида серы в возбужденном состоянии, который, реагируя с молекулярным кислородом, образует SO3:
S02 + hn ® SO2*, 290нм< l< 400нм
SO2* + 202 ® S03 + О3
Образующийся SO3 вступает во взаимодействие с молекулой воды:
S03 + Н20 ® H2SO4 (1)
Однако, как показали исследования последних десятилетий, рассмотренный механизм является возможным, но никак не основным процессом окисления SO2 в газовой фазе.
Таким образом данный механизм окисления не играет существенной роли в трансформации соединений серы в тропосфере, а ведущую роль играют свободные радикалы. Протекающие при этом процессы можно представить следующими уравнениями реакций:
S02 + ·ОН + М ® HS03 + М*
HS03 + Н02· ® S03 + 2·0H
S02 + Н02· ® S03 + ·ОН
S02 + CH3O2· ® S03 + CH30·
Скорость трансформации диоксида серы в воздухе, имеющем средние для тропосферы значения концентраций свободных радикалов, составляет примерно 0,1%×ч-1, что соответствует времени пребывания SO2 в тропосфере, равному 5 суткам. Процесс трансформации диоксида серы резко ускоряется в воздухе промышленных регионов, где увеличивается содержание свободных радикалов. Скорость в этом случае может возрасти до 1%×ч-1
Триоксид серы — серный ангидрид — легко взаимодействует с частицами атмосферной влаги и образует растворы серной кислоты [см. уравнение (1)], которые, реагируя с аммиаком или ионами металлов, присутствующими в частицах атмосферной влаги, частично переходят в соответствующие сульфаты. В основном это сульфаты аммония, натрия, кальция. Образование сульфатов происходит и в процессе окисления на поверхности твердых частиц, присутствующих в воздухе. В этом случае стадии окисления предшествует адсорбция, часто сопровождающаяся химической реакцией (второй путь окисления диоксида серы):
S02 + СаО ® CaSO3
или
S02 + MgO ® MgS03.
Оксиды железа, алюминия, хрома и других металлов, которые также могут находиться в воздухе, резко ускоряют процесс окисления диоксида серы. Как показали лабораторные эксперименты, в присутствии, например, частиц Fe203 скорость процесса трансформации SO2 составляет примерно 100%×ч-1. Необходимо отметить, однако, что данное значение получено для воздуха, в котором содержание оксидов железа в 100-200 раз превышало фоновые концентрации. Поэтому данный процесс трансформации диоксида серы играет основную роль лишь в сильно запыленном воздухе, содержащем значительные количества оксидов металлов.
Третий путь окисления диоксида серы в тропосфере связан с предварительной абсорбцией SO2 каплями атмосферной влаги. В дождливую погоду и при высокой влажности атмосферы этот путь окисления может стать основным в процессе трансформации диоксида серы. В качестве окислителя в природных условиях часто выступает пероксид водорода. При высоких значениях рН, когда в растворе в основном находятся ионы SO32-, скорость окисления заметно возрастает. Конечным продуктом окисления, как и в случае окисления в газовой фазе, является серная кислота, которая в дальнейшем может перейти в сульфаты.
Помимо процессов химической трансформации диоксида серы в серную кислоту и сульфаты сток (вывод из атмосферы) этих соединений происходит в результате процессов мокрого (с атмосферными осадками) и сухого (при контакте с поверхностью почвы, водоема или с растительностью) осаждения.
Представленная на рис. схема наглядно иллюстрирует тропосферную часть цикла неорганических соединений серы.
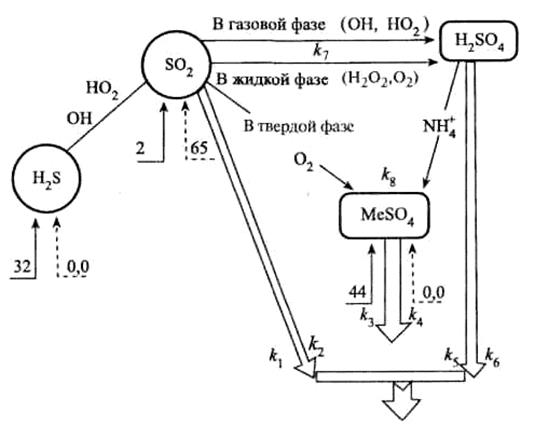
Рис.
Трансформация неорганических соединений серы в тропосфере (числа — млн т элементной серы в год):
® природные поступления соединений серы;
---® антропогенные поступления соединений серы;
Þ вывод из атмосферы.
Необходимо отметить, что диоксид серы — один из наиболее вредных газов из числа распространенных загрязнителей воздуха. Он особенно опасен для здоровья людей, страдающих заболеваниями дыхательных путей. Установлена линейная корреляция между концентрацией SO2 в воздухе и частотой заболеваний населения хроническим бронхитом:
у= 14,5х -1,3,
где у — процент заболевания бронхитом; х — концентрация SО2 в воздухе, мг/м3.
Из указанной зависимости следует, что при концентрации SО2 в воздухе 0,5 мг/м3 заболеваемость бронхитом у населения составит 6%, при концентрации 1,0 мг/м3 — 13,2%, при 5 мг/м3 — 71,2%, а при концентрации 6,8 мг/м3 все население заболеет бронхитом. Эти прогнозы совпадают с результатами исследований, проведенных в Германии и других европейских странах.
Кислотные дожди
Основной вред окружающей среде наносит не столько сам SO2, сколько продукт его окисления — SO3. Поскольку затем происходит образование в атмосферной влаге серной кислоты [см. уравнение (1)], а это приводит к выпадению так называемых кислотных дождей. Особенно распространено это явление в странах Скандинавии, Северной Европе, на севере США и юге Канады. Из-за выпадения кислотных дождей уменьшается рН пресноводных водоемов, что приводит к гибели рыб и других водных организмов (подробнее см. лекцию о закислении водоемов). Под действием кислотных дождей ускоренно корродируют металлоконструкции, нарушается целостность лакокрасочных покрытий, разрушаются здания и памятники архитектуры. Так, атмосферная серная кислота реагирует с мрамором (СаСО3) с образованием CaSO4, что приводит к шелушению камня.
В кислой среде возрастает растворимость Аl(ОН)3 При концентрации > 0,2 мг/л Аl3+ в воде токсичен для рыб, к тому же алюминий связывает фосфаты, что приводит к снижению питательных запасов в водоеме. В кислой среде повышается возможность перехода в раствор и ионов других металлов, что также создает опасность токсического загрязнения водных и почвенных экосистем.
Кислотные дожди влияют на структуру и строение почв, приводят к гибели растений (главным образом хвойных деревьев). При закислении почв происходит выщелачивание ионов кальция, магния и калия, возрастает подвижность ионов токсичных металлов, меняется состав почвенных микроорганизмов.
