Роль повреждения ткани в развитии воспаления
Альтерация(alteratio, от лат. alterare - изменять), или дистрофия, повреждение ткани, нарушение в ней питания (трофики) и обмена веществ, ее структуры и функции.Различают первичную и вторичную альтерацию.
Первичная альтерацияявляется результатом повреждающего воздействия самого воспалительного агента, поэтому ее выраженность при прочих равных условиях (реактивность организма, локализация) зависит от свойств флогогена. Строго говоря, первичная альтерация не является компонентом воспаления, так как воспаление есть реакция на повреждение, вызванное флогогеном, т.е. на первичную альтерацию. В то же время практически первичные и вторичные альтеративные явления трудно отделимы друг от друга.
Вторичная альтерацияявляется следствием воздействия на соединительную ткань, микрососуды и кровь высвободившихся внеклеточно лизосомальных ферментов и активных метаболитов кислорода. Их источником служат активированные иммигрировавшие и циркулирующие фагоциты, отчасти - резидентные клетки. При воспалении у животных с предварительно вызванной лейкопенией альтерация выражена слабо. Определенную роль в альтерации может играть также литический комплекс С5b-С9, образующийся при активации комплемента плазмы и тканевой жидкости.
Вторичная альтерация не зависит от воспалительного агента, для ее развития необязательно дальнейшее присутствие флогогена в очаге. Она является реакцией организма на уже вызванное вредным началом повреждение. Это целесообразный и необходимый компонент воспаления как защитно-приспособительной реакции, направленный на скорейшее отграничение (локализацию) флогогена и (или) поврежденной под его воздействием ткани от остального организма. Ценой повреждения достигаются и другие важные защитные явления: более выраженный микробицидный и литический эффект лизосомальных ферментов и активных метаболитов кислорода, поскольку он осуществляется не только в фагоцитах, но и внеклеточно; вовлечение других медиаторов воспаления и клеток, усиленная экссудация, эмиграция и фагоцитоз. В результате воспалительный процесс завершается быстрее. Однако альтерация целесообразна лишь в известных пределах. Так, например, при дисбалансе в системе лизосомальные протеиназы -
их ингибиторы возникают избыточные проявления альтерации с преобладанием некроза.
Альтеративные явления при воспалении включают тканевой распади усиленный обменвеществ («пожар обмена»), приводящие к ряду физико-химических изменений в воспаленной ткани: накоплению кислых продуктов (ацидоз,или Н+-гипериония),увеличению осмотического давления (осмотическая гипертензия,или гиперосмия),повышению коллоидно-осмотического, или онкотического, давления (гиперонкия).
В зависимости от силы повреждающего агента, интенсивности и локализации воспаления морфологические проявления альтерации широко варьируют: от едва заметных структурно-функциональных изменений до полной деструкции (некробиоз)и гибели (некроз)тканей и клеток. Обнаруживаются мутное набухание цитоплазмы клеток, явления белковой, жировой и других видов их дистрофии. Резко повышается проницаемость мембран клеток и клеточных органелл. Изменяются и субклеточные структуры - митохондрии, лизосомы, рибосомы, эндоплазматическая сеть. Митохондрии набухают или сморщиваются, кристы их разрушаются. Повышение проницаемости и повреждение мембран лизосом сопровождаются выходом разнообразных ферментов, играющих роль в разрушении субклеточных структур. Изменяются форма и величина цистерн эндоплазматического ретикулума, в цитоплазме появляются везикулы, концентрические структуры и др. Отмечаются краевое расположение хроматина, повреждение мембраны ядра. В строме наблюдаются мукоидное и фибриноидное набухание вплоть до некроза, растворение коллагеновых и эластических волокон.
Повышение обмена веществ при воспалениипроисходит преимущественно за счет углеводов. Первоначально усиливается как их окисление, так и гликолиз. В основе этого явления лежит активация соответствующих тканевых ферментов. Заметно увеличивается потребление кислорода воспаленной тканью. По мере накопления в очаге лейкоцитов, лизосомальные ферменты которых расщепляют углеводы анаэробным путем, а также повреждения и снижения количества митохондрий в ходе альтерации, реакции окисления заметно ослабевают, а гликолиза - нарастают. Соответственно расщепление углеводов не всегда доходит до конечных продуктов - углекислого газа и воды. Дыхательный коэффициент снижается. В ткани накапливаются недоокисленные продукты углеводного обмена - молочная и трикарбоновые кислоты.
Кроме того, вследствие нарушения обмена жиров, белков и распада нуклеиновых кислот в очаге нарастает содержание жирных кислот, кетоновых тел, полипептидов, аминокислот, нуклеотидов (АТФ, адениловая кислота), нуклеозидов (аденозин). В результате развивается ацидоз. Первоначально он компенсируется тканевыми буферными системами и ускоренным крово- и лимфотоком. По мере истощения буферных систем и замедления крово- и лимфотока ацидоз нарастает и становится некомпенсированным. Если в норме концентрация водородных ионов в ткани составляет 0,5?10-7, т.е. рН равен 7,34, то при воспалении может быть, соответственно, 25?10-7 и 5,6 и ниже. Чем острее протекает воспалительный процесс, тем более выражен ацидоз. Так, при остром гнойном воспалении рН составляет 6,5-5,39, а при хроническом - 7,1-6,6. Ацидоз принимает участие в повышении проницаемости сосудов. Он создает благоприятные условия для реализации разрушительных эффектов лизосомальных ферментов, в частности гликозидаз, расщепляющих углеводные компоненты матрикса соединительной ткани.
Наряду с Н+-гиперионией в очаге нарастает содержание и других ионов - ионов калия, натрия, кальция. Это обусловлено разрушением клеток и усиленной диссоциацией в кислой среде солей. Вследствие опережающего повышения уровня внеклеточного калия нарушается соотношение ионов калия и кальция (дизиония).Изменения в гомеостазе ионов Са2+ могут лежать в основе гибели клеток в очаге воспаления. Са2+ является одним из вторичных мессенджеров между мембраной и клеточными ферментными системами, а также генным аппаратом. Повышение уровня внутриклеточного Са2+ приводит к абсорбции его митохондриальными мембранами и последующим блокированием дыхательной цепи электронов. Повышенное внутриклеточное содержание Са2+ активирует нелизосомальные протеазы, приводя к лизису цитоскелета, деградации энзимов, мембрано-ассоциированных белков (ионных каналов, переносчиков, рецепторов, молекул адгезии). Отмечено, что хотя снижение внеклеточного Са2+ важно для выживания клеток, это может быть препятствием к их новому росту. В очаге воспаления нарастает молекулярная концентрация, поскольку в процессе тканевого распада и усиленного обмена веществ происходит расщепление крупных молекул до множества мелких. Вследствие повышения ионной и молекулярной концентрации развивается гиперосмия. Так, если в норме депрессия межклеточной жидкости
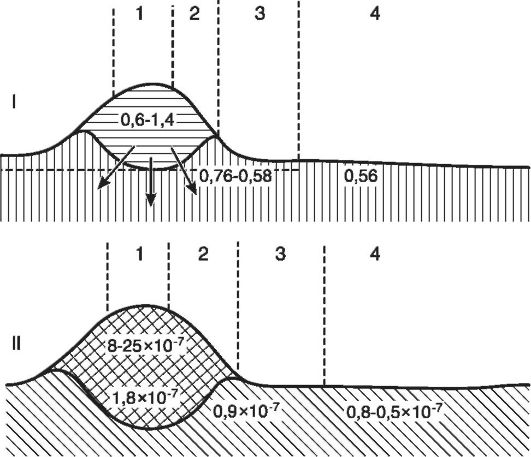 Рис. 10-4.Схематическое изображение разреза через воспалительный отек кожи: I - изменения осмотического давления (А°С) в разных зонах очага воспаления: 1 - центр воспаления, 2 - зона полнокровия, 3 - зона явного отека, 4 - зона латентного отека; II - изменения концентрации ионов водорода: 1 - центр гнойного воспаления, 2 - зона воспалительного инфильтрата, 3 - зона периферического отека, 4 - зона перехода к нормальному состоянию (по Шаде)
Рис. 10-4.Схематическое изображение разреза через воспалительный отек кожи: I - изменения осмотического давления (А°С) в разных зонах очага воспаления: 1 - центр воспаления, 2 - зона полнокровия, 3 - зона явного отека, 4 - зона латентного отека; II - изменения концентрации ионов водорода: 1 - центр гнойного воспаления, 2 - зона воспалительного инфильтрата, 3 - зона периферического отека, 4 - зона перехода к нормальному состоянию (по Шаде)
составляет 0,62°, т.е. осмотическое давление равно 8 атм, то при гнойном воспалении - соответственно 0,80° и 19 атм (рис. 10-4).
В результате физико-химических изменений воспаленной ткани, расщепления белков до полипептидов и аминокислот с увеличением концентрации последних происходит увеличение дисперсности коллоидов, их способности притягивать и задерживать воду. Развивается гиперонкия. Изменения осмотического и онкотического давления являются важным фактором экссудации и, соответственно, воспалительного отека.
Медиаторы воспаления
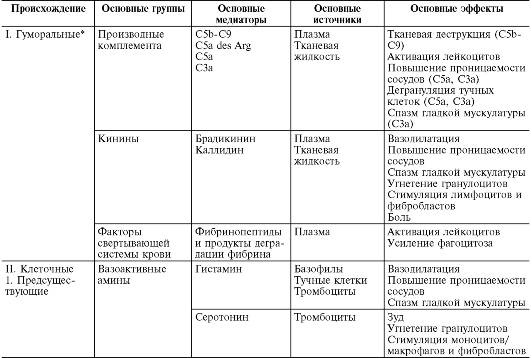
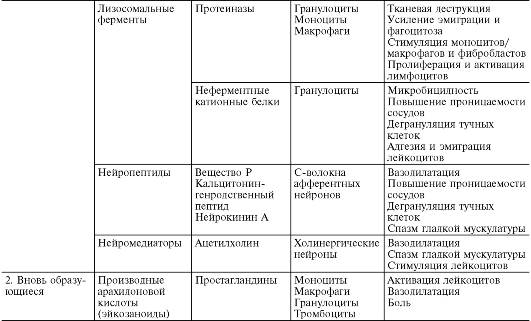
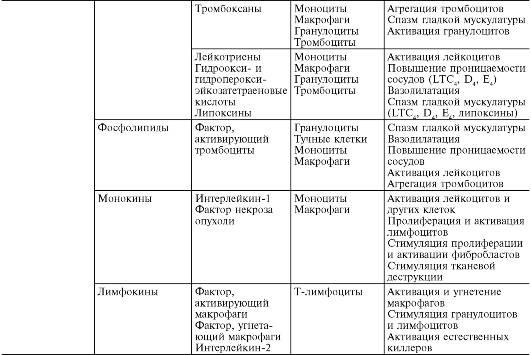
В ходе первичной и вторичной альтерации высвобождаются большие количества разнообразных медиаторов и модуляторов воспаления (табл. 10-1).
Таблица10-1. Медиаторы воспаления
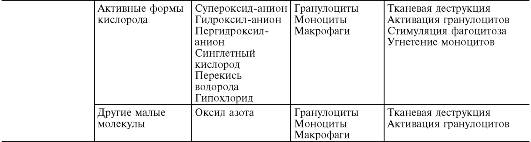 *Все предсуществующие.
*Все предсуществующие.
Под медиаторами (посредниками) воспаления понимают биологически активные вещества, реализующие возникновение и поддержку различных воспалительных явлений, например повышение сосудистой проницаемости, эмиграцию и т.д. При нормальной жизнедеятельности эти же вещества в физиологических концентрациях ответственны за регуляцию функций клеток или тканей. При воспалении, высвобождаясь в больших количествах, они приобретают новое качество - медиаторов воспаления. Практически все медиаторы являются и модуляторами воспаления, т.е. способны усиливать или ослаблять выраженность воспалительных явлений. Соответственно эффект медиатора может быть добавочным (аддитивным), потенцирующим (синергистическим) и ослабляющим (антагонистическим),а взаимодействие медиаторов возможно на уровне их синтеза, секреции или эффектов. Медиаторное звено является основным в патогенезе воспаления. Оно координирует взаимодействие множества клеток - эффекторов воспаления, смену клеточных фаз в очаге воспаления.
Медиаторывоспаления по происхождению делятся на гуморальные(образующиеся в жидких средах - плазме крови и тканевой жидкости) и клеточные.Все гуморальные медиаторы являются предсуществующими,т.е. имеются в виде предшественников до активации последних; к ним относятся производные комплемента, кинины и факторы свертывающей системы крови. Среди клеточных медиаторов выделяют предсуществующие(депонированные в клетках в неактивном состоянии) - вазоактивные амины, лизосомальные ферменты, нейропептиды, и вновь образующиеся(т.е. продуцируемые клетками при стимуляции) - эйкозаноиды, цитокины, лимфокины, активные метаболиты кислорода.
Основными источниками клеточных медиаторов являются:
1. Нейтрофилы,которые выделяют катионные белки, стимулируют высвобождение биогенных аминов из тромбоцитов и тучных клеток, содержат ингибитор высвобождения гистамина и гистаминазу. Протеазы нейтрофилов участвуют в образовании кининов и активных фрагментов комплемента (С3а, С3Ь). Нейтрофилы образуют простагландин (PG) E2 и другие эйкозаноиды. Ферменты нейтрофилов активируют как свертывание крови, так и фибринолиз.
2. Макрофагивыделяют ангиотензин-конвертазу, которая инактивирует брадикинин, превращает ангиотензин-I в ангиотензин-П. Они синтезируют PGE2, а также тромбоксаны и лей-
котриены (LT). Поскольку PGE2 препятствует высвобождению клеточных медиаторов воспаления и подавляет агрегацию тромбоцитов, макрофаги, помимо провоспалительной, обладают и противовоспалительной функцией. Макрофаги синтезируют различные компоненты комплемента, обладают свертывающей и фибринолитической активностью.
3. Эозинофилыслужат отрицательными модуляторами воспаления. Они содержат гистаминазу, кининазу, ферменты, расщепляющие лейкотриены С и D (лизофосфалипазу, арилсульфатазу В, фосфолипазу D), главный щелочной белок, осуществляющий цитотоксическую функцию и нейтрализующий гепарин. Таким образом, ферменты эозинофилов нейтрализуют продукты тучных клеток, способствуют уничтожению клеточных остатков. Эозинофилы фагоцитируют секретируемые тучными клетками гранулы и подавляют высвобождение гистамина. Особый интерес представляет присутствие в эозинофилах лизофосфолипазы. Ее субстратом являются частично деградированные фосфолипиды, содержащиеся в мембранах погибших клеток. Высвобождая из фосфолипидов свободные жирные кислоты, лизофосфолипаза способствует образованию арахидоновой кислоты.
4. Тучные клетки и базофилывыделяют гистамин и серотонин, гепарин, факторы хемотаксиса нейтрофилов и эозинофилов, фактор активации тромбоцитов, протеолитические ферменты, они продуцируют пероксидазу, супероксид и пероксид водорода, а также протеазу, превращающую кининоген в кинин.
5. Тромбоцитысекретируют факторы роста и свертывания, вазоактивные амины и липиды, нейтральные и кислые гидролазы.
Производные комплемента(рис. 10-5) являются наиболее важными из гуморальных медиаторов воспаления. Среди почти 20 различных белков, образующихся при активации комплемента, непосредственное отношение к воспалению имеют его фрагменты С5а, С3а, С3Ь и комплекс С5Ь-С9:
• С5а и С3а являются медиаторами острого воспаления и анафилатоксинами (т.е. либераторами гистамина из тучных клеток), таким образом, они повышают проницаемость капилляров как прямо, так и опосредованно через гистамин (рис. 10-6);
• С5а des Arg и С3а образуются из С5а в плазме и тканевой жидкости под влиянием карбоксипептидазы N и повышают проницаемость посткапиллярных венул. Эффект С5а des Arg
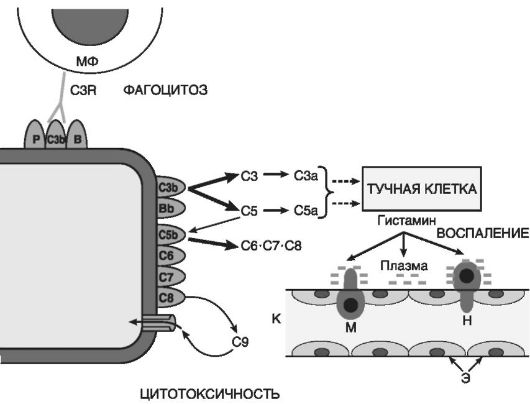 Рис. 10-5. Компоненты системы комплемента: C3b, C5b - фрагменты С3 и С5, связанные с мембраной; С3а и С5а - пептиды, отщепившиеся, соответственно, от С3 и С5; С6-С8 - компоненты комплекса, атакующего мембраны; С9 - белок, полимеризующийся в мембране; Bb - фрагмент белка В, связанный с мембраной; стрелки - каскадно-усиливающиеся компоненты реакции; МФ - макрофаг; C3R - рецептор к C3b компоненту комплемента; К - капилляр; Э - эндотелиальная выстилка капилляра; Н и М - диапедез нейтрофила и моноцита
Рис. 10-5. Компоненты системы комплемента: C3b, C5b - фрагменты С3 и С5, связанные с мембраной; С3а и С5а - пептиды, отщепившиеся, соответственно, от С3 и С5; С6-С8 - компоненты комплекса, атакующего мембраны; С9 - белок, полимеризующийся в мембране; Bb - фрагмент белка В, связанный с мембраной; стрелки - каскадно-усиливающиеся компоненты реакции; МФ - макрофаг; C3R - рецептор к C3b компоненту комплемента; К - капилляр; Э - эндотелиальная выстилка капилляра; Н и М - диапедез нейтрофила и моноцита
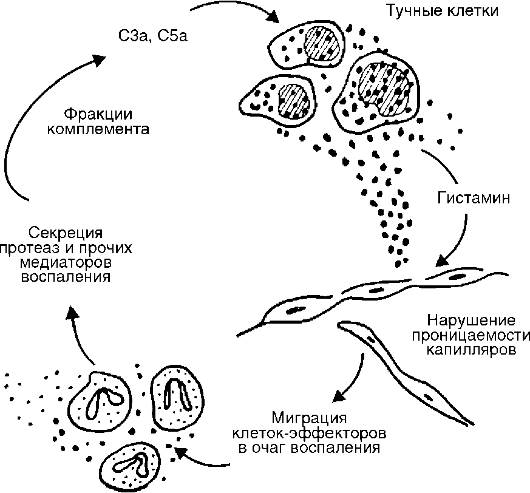 Рис. 10-6. Связь комплемента с тучными клетками в очаге острого воспаления
Рис. 10-6. Связь комплемента с тучными клетками в очаге острого воспаления
не связан с гистамином, но является нейтрофилзависимым, т.е. осуществляется за счет факторов проницаемости, высвобождаемых из полиморфно-ядерных гранулоцитов, - лизосомальных ферментов и неферментных катионных белков, активных метаболитов кислорода. Кроме того, С5а и С5а des Arg привлекают нейтрофилы. В отличие от них С3а практически не обладает хемотаксическими свойствами;
• С3Ь опсонизирует патогенный агент и, соответственно, способствует иммунной адгезии и фагоцитозу;
• комплекс С5Ь-С9 ответствен за лизис микроорганизмов и патологически измененных клеток.
Источником комплемента служат плазма крови и в меньшей мере тканевая жидкость. Усиленное поступление плазменного комплемента в ткань является одним из важных назначений экссудации. Активные компоненты комплемента высвобождают не только гистамин, но и интерлейкин (IL) 1, простагландины, лейкотриены, фактор, активирующий тромбоциты, и синергистически взаимодействуют с простагландинами и веществом Р.
Кинины- вазоактивные пептиды, образующиеся из кининогенов (а2-глобулинов) под влиянием калликреинов в плазме (брадикинин) и в тканевой жидкости (каллидин). Пусковым фактором активации калликреин-кининовой системы является активация при повреждении ткани фактора Хагемана (XII), превращающего прекалликреины в калликреины. Фактор XII присутствует в крови и имеет сродство к отрицательно заряженным поверхностям. В жидкой фазе крови он спонтанно диссоциирует на два фрагмента: ХПа - ферментативно активный фрагмент и ХПб. ХIIa адсорбируется на поверхности чужеродного агента (флогогена), где стабилизируется. Он обладает протеолитической активностью, субстратом которой являются сам фактор ХП и другой белок - прекаллекреин. Далее прекалликреин под действием ХПа превращается в протеазу калликреин. Калликреин резко усиливает образование ХНа из фактора ХП и одновременно действует на новый субстрат - так называемый высокомолекулярный кининоген (ВМК). Под действием калликреина из ВМК образуется брадикинин, являющийся одним из главных медиаторов воспаления. Брадикинин действует на эндотелий сосудов, вызывая «размыкание» краев клеток сосудистого эндотелия и открывая тем самым путь плазме крови в очаг воспаления. Таким образом, данная система обнаруживает чужеродное тело по его отрицательно заряженной
поверхности. Поверхности же собственных клеток устроены так, что они не адсорбируют ХПа, не стабилизируют его и не индуцируют тем самым дальнейшую цепь событий. Это самый простой и примитивный способ отличать «свое» от «несвоего».
Кинины опосредуют расширение артериол и повышают проницаемость венул путем контракции эндотелиальных клеток. Они сокращают гладкую мускулатуру вен и повышают внутрикапиллярное и венозное давление, угнетают эмиграцию нейтрофилов, модулируют распределение макрофагов, стимулируют миграцию и митогенез Т-лимфоцитов и секрецию лимфокинов. Кроме того, они усиливают пролиферацию фибробластов и синтез коллагена и, следовательно, имеют значение в репаративных явлениях при хроническом воспалении. Одним из важнейших эффектов кининов является присущая им способность раздражать окончания чувствительных нервов, обусловливая возникновение воспалительной боли. Кинины усиливают высвобождение гистамина из тучных клеток, синтез простагландинов многими типами клеток, поэтому некоторые из их основных эффектов - вазодилатация, сокращение гладкой мускулатуры, боль - связывают с высвобождением других медиаторов, особенно простагландинов.
Активация фактора Хагемана запускает не только процесс кининообразования, но и свертывания крови и фибринолиза. При этом образуются такие медиаторы, как фибринопептиды и продукты деградации фибрина, которые являются мощными хематтрактантами.
Эйкозаноиды(рис. 10-7) являются важным медиаторным звеном воспалительной реакции, о чем свидетельствуют их продолжительная продукция в очаге и тесная связь с ключевым событием воспаления - лейкоцитарной инфильтрацией, а также мощный противовоспалительный эффект ингибиторов их синтеза. В очаге воспаления основными продуцентами эйкозаноидов являются моноциты и макрофаги, хотя они образуются почти всеми типами ядерных клеток при стимуляции последних. Преобладающими эйкозаноидами в очаге воспаления оказываются простагландины(PGE2), лейкотриены(LTB4) и 5-гидропероксиэйкозатетраеновая кислота(5-HPETE). Образуются также, хотя и в меньшем количестве, тромбоксан A1 (TхA2), PGF2a, PGD2, простациклин (PGI2), LTC4, LTD4, LTE4, другие HPETE. Главным эффектом эйкозаноидов является их влияние на лейкоциты; как мощные хематтрактанты они играют важную роль в механизмах самоподдержания лейкоцитарной инфильтрации.
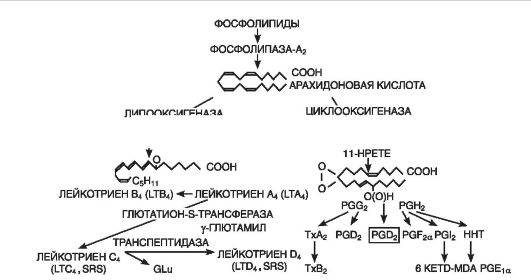
Рис. 10-7.Образование лейкотриенов и простагландинов из мембраны клетки (по D. Gemsa et al., 1981): Тх - тромбоксан; PG (prostaglandin) - простагландин; LT (leukotrien) - лейкотриен; HPETE (hydroxyperoxy-eicosatetranoic acid) - гидропероксиэйкозатетраеновая кислота
Простагландинысами не повышают сосудистую проницаемость, но, будучи сильными вазодилататорами, усиливают гиперемию и, следовательно, экссудацию. Простагландины и лейкотриены имеют значение в генезе воспалительной боли. При этом PGE2, не обладая прямой болевой активностью, повышает чувствительность рецепторов афферентных болевых нервных окончаний к брадикинину и гистамину. PGE2 является сильным жароповышающим агентом и участвует в развитии лихорадки. Простагландины играют ключевую роль в модуляции воспалительного процесса, регулируя экссудацию, эмиграцию и дегрануляцию лейкоцитов, а также фагоцитоз. Так, например, PGE потенцируют развитие отека, вызванного гистамином или брадикинином, а PGF1a, напротив, ослабляют. Аналогичным образом PGE и PGF1a действуют на эмиграцию лейкоцитов.
Лейкотриены(синтезируются во всех клетках крови, кроме эритроцитов, а также в адвентиции сосудов, тучных клетках, легких) способствуют сокращению гладкой мускулатуры желудочнокишечного тракта, оказывают сосудосуживающее действие (в том числе коронарных артерий). LTC4, LTD4, LTE4 повышают проницаемость сосудов путем прямой контракции эндотелиальных клеток, а LTB4 - как нейтрофилзависимый медиатор. Лейкотриены при-
водят к спазму гладкой мускулатуры бронхов (эффект бронхоспазма в отличие от вызванного гистамином развивается медленнее, но является более продолжительным), развитию отека, привлечению эозинофилов, повышению секреции слизи и нарушению ее транспорта. Органом-мишенью для лейкотриенов является сердце. Выделяясь в избытке, они ингибируют (на 60%) сократимость сердечной мышцы, уменьшая коронарный кровоток и усиливая воспалительную реакцию. Лейкотриены широко взаимодействуют с другими медиаторами воспаления. Они усиливают бронхоспастическое действие гистамина, ацетилхолина, простагландинов и тромбоксанов, стимулируют высвобождение простагландинов и тромбоксанов.
Тромбоксаны(образуются в ткани мозга, селезенки, легких и в тромбоцитах, клетках воспалительной гранулемы) вызывают адгезию и агрегацию тромбоцитов, способствуют развитию тромбоза при ишемической болезни сердца, оказывают вазоспастическое действие.
Модуляторная функция эйкозаноидов осуществляется через изменения соотношения циклических нуклеотидов в клетках.
Биогенные амины - гистамин и серотонинсчитаются основными медиаторами первоначальных микроциркуляторных нарушений в очаге острого воспаления и немедленной фазы повышения проницаемости сосудов.
Незначительное количество нейромедиатора серотонинасодержится в тучных и энтерохромаффинных клетках, но главным его источником являются тромбоциты. Эффекты серотонина неоднозначны и меняются в зависимости от количества. В обычных физиологических условиях серотонин является вазоконстриктором, вызывает пролонгированный спазм сосудов, повышает их тонус. При воспалении количество серотонина резко возрастает. В высоких концентрациях серотонин является вазодилататором, расширяет сосуды, повышает проницаемость, причем в 100 раз более эффективно по сравнению с гистамином. Серотонин способен вызывать непосредственную контракцию эндотелиальных клеток венул и является также медиатором боли. Кроме того, серотонин стимулирует моноциты в очаге воспаления.
Гистаминдействует двояко в отношении сосудов и клеток. Через Н1-рецепторы он расширяет артериолы и угнетает эмиграцию и дегрануляцию лейкоцитов, а через H1-рецепторы суживает венулы, повышая таким образом внутрикапиллярное давление, и сти-
мулирует эмиграцию и дегрануляцию лейкоцитов. При обычном течении воспаления гистамин действует преимущественно через Н1-рецепторы на нейтрофилах, ограничивая их функциональную активность, и через Н1-рецепторы на моноцитах, стимулируя их. Таким образом, наряду с провоспалительными сосудистыми эффектами он оказывает противовоспалительное действие. Обладая способностью к регуляции пролиферации, дифференцировки и функциональной активности фибробластов, гистамин участвует в процессах репарации. Модуляторные эффекты гистамина также опосредуются циклическими нуклеотидами.
Что касается взаимодействий биогенных аминов в очаге воспаления, то известно, что гистамин через H1-рецепторы может запускать или усиливать синтез простагландинов, а через Н2-рецепторы - угнетать. Взаимодействуя как между собой, так и с брадикинином, нуклеотидами и нуклеозидами, веществом Р, биогенные амины повышают проницаемость сосудов. Сосудорасширяющее действие гистамина усиливается в комплексе с ацетилхолином, серотонином, брадикинином.
Лизосомальные ферментывысвобождаются в очаге воспаления из гранулоцитов и моноцитов-макрофагов в ходе их хемотаксической стимуляции, миграции, фагоцитоза, повреждения, гибели. В гранулах нейтрофилов содержатся протеиназы - эластаза, катепсин G и коллагеназы, которые обеспечивают противомикробную защиту, лизируя убитые микроорганизмы. Они обладают медиаторным и модуляторным эффектами в отношении сосудистой проницаемости, эмиграции, фагоцитоза.
Повышение проницаемости сосудов под влиянием лизосомальных ферментов происходит за счет лизиса субэндотелиального матрикса, истончения и фрагментации эндотелиальных клеток и сопровождается геморрагией и тромбозом. Образуя или расщепляя важнейшие хемотаксины, лизосомальные ферменты модулируют лейкоцитарную инфильтрацию. В зависимости от концентрации они могут и сами усиливать или угнетать миграцию нейтрофилов. Нейтральные протеиназы способны модулировать фагоцитоз. Например, эластаза образует опсонин С3Ь, необходимый для адгезии частиц к поверхности нейтрофила. Следовательно, нейтрофил сам обеспечивает себе механизм усиления фагоцитоза. Как катепсин G, так и эластаза повышают сродство Fc-рецептора мембраны нейтрофила к комплексам иммуноглобулинов и, соответственно, усиливают эффективность поглощения частиц.
Благодаря способности лизосомальных ферментов активировать системы комплемента, калликреин-кининовую, свертывания и фибринолиза, высвобождать цитокины и лимфокины, воспаление развертывается и самоподдерживается в течение длительного времени.
Неферментные кат ионные белки,содержащиеся в азурофильных и в специфических гранулах нейтрофилов, обладают таким важным свойством, как высокая микробицидность. В этом отношении они находятся в синергистическом взаимодействии с системой миелопероксидаза - перекись водорода. Катионные белки сорбируются на отрицательно заряженной мембране бактериальной клетки путем электростатического взаимодействия, нарушая проницаемость и структуру ее оболочки. Затем наступает гибель микроорганизма с последующим эффективным лизисом его лизосомальными протеиназами. Кроме того, высвободившиеся катионные белки опосредуют повышение проницаемости сосудов (способствуя дегрануляции тучных клеток и высвобождению гистамина), а также адгезию и эмиграцию лейкоцитов.
Цитокиныпри воспалении продуцируются главным образом стимулированными моноцитами и макрофагами (монокины), а также нейтрофилами, лимфоцитами, эндотелиальными и другими клетками. Цитокины повышают сосудистую проницаемость (нейтрофилзависимым путем), адгезию и эмиграцию лейкоцитов. Наряду с провоспалительными свойствами цитокины важны и для непосредственной защиты организма, поскольку стимулируют нейтрофилы и моноциты к умерщвлению, поглощению и перевариванию внедрившихся микроорганизмов, а также усиливают фагоцитоз путем опсонизации патогенного агента. Стимулируя раневое очищение, пролиферацию и дифференцировку клеток, цитокины усиливают репаративные процессы. Наряду с этим они могут опосредовать тканевую деструкцию (деградацию хрящевого матрикса и резорбцию кости) и, таким образом, играть роль в патогенезе заболеваний соединительной ткани, в частности ревматоидного артрита. Действие цитокинов вызывает также ряд метаболических эффектов, лежащих в основе общих проявлений воспаления - лихорадки, сонливости, анорексии, изменения обмена веществ, стимуляции гепатоцитов к усиленному синтезу белков острой фазы, активации системы крови и т.д. Цитокины взаимодействуют между собой, с простагландинами, нейропептидами и другими медиаторами.
К медиаторам воспаления (цитокинам) относится также ряд лимфокинов- полипептидов, продуцируемых стимулированными лимфоцитами. Лимфокины координируют взаимодействие нейтрофилов, макрофагов и лимфоцитов, регулируя воспалительную реакцию в целом.
Активные метаболиты кислорода,прежде всего свободные радикалы - супероксидный анион-радикал (О*-) , гидроксильный радикал (НО*), гидроперекисный радикал (НО*,), вследствие наличия на их внешней орбите одного или нескольких непарных электронов обладают повышенной реактивностью с другими молекулами и, следовательно, значительным деструктивным потенциалом, который имеет значение в патогенезе воспаления (рис. 10-8).
Источником активных форм кислорода - кислородных радикалов, перекиси водорода (Н1О1), синглетного кислорода (1О1), гипохлорита (HOCl) и др. - служат: респираторный взрыв фагоцитов при их стимуляции, каскад арахидоновой кислоты в процессе образования эйкозаноидов, ферментные процессы в эндоплазматическом ретикулуме и пероксисомах, митохондриях, цитозоле, а также самоокисление малых молекул, таких как гидрохиноны, лейкофлавины, катехоламины и др.
Радикалы кислорода повышают бактерицидную способность фагоцитов, а также имеют медиаторную и модуляторную функ-
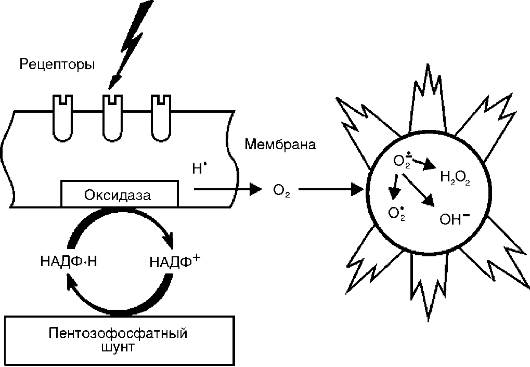 Рис. 10-8. Индукция активных форм кислорода при активации оксидазной системы клеточной мембраны
Рис. 10-8. Индукция активных форм кислорода при активации оксидазной системы клеточной мембраны
ции. Будучи медиаторами воспаления, активные метаболиты кислорода вызывают перекисное окисление липидов, повреждение белков, углеводов, нуклеиновых кислот, что повышает проницаемость сосудов (вследствие повреждения эндотелиальных клеток) и способствует стимуляции фагоцитов. Как модуляторы, они могут усиливать воспалительные явления (высвобождая ферменты и взаимодействуя с ними при повреждении ткани) или оказывать противовоспалительный эффект (инактивация лизосомальных гидролаз и других медиаторов воспаления). Большое значение имеют активные метаболиты кислорода в поддержании хронического воспаления.
К медиаторам и модуляторам воспаления относят также нейропептиды- вещества, высвобождаемые С-волокнами в результате активации воспалительным агентом полимодальных ноцицепторов, играющих важную роль в возникновении аксон-рефлексов в конечных разветвлениях первичных афферентных (чувствительных) нейронов. Наиболее изученными являются вещество Р, кальцитонин-генсвязанный пептид, нейрокинин А. Нейропептиды повышают проницаемость сосудов, и эта их способность во многом опосредована медиаторами, происходящими из тучных клеток. Между немиелиновыми нервами и тучными клетками имеются мембранные контакты, которые обеспечивают сообщение центральной нервной системы с очагом воспаления. Нейропептиды синергистически взаимодействуют в повышении проницаемости сосудов как между собой, так и с гистамином, брадикинином, С5а, фактором, активирующим тромбоциты, лейкотриеном В4; антагонистически - с АТФ и аденозином. Они оказывают также потенцирующее воздействие на привлечение и цитотоксическую функцию нейтрофилов, усиливают адгезию нейтрофилов к эндотелию венул. Кроме того, нейропептиды повышают чувствительность ноцицепторов к действию различных медиаторов, в частности простагландина E1 и простациклина, участвуя таким образом в формировании боли при воспалении.
Кроме вышеперечисленных веществ, к медиаторам воспаления относятся также ацетилхолин и катехоламины,высвобождающиеся при возбуждении холин- и адренергических структур. Ацетилхолин вызывает расширение сосудов и играет роль в аксон-рефлекторном механизме артериальной гиперемии при воспалении. Норадреналин и адреналин тормозят рост сосудистой проницаемости, выступая главным образом как модуляторы воспаления.
