Основы клинической энзимологии
(ФЕРМЕНТОЛОГИИ)
●
Интенсивная разработка теоретических основ и практических аспектов клинической ферментологии в последние десятилетия позволила получить новые исключительной важности сведения о строении, свойствах, методах выделения, кинетике и механизме действия, а также биологических функциях ферментов в норме и при патологии. Это открыло новую эру в вопросах ранней, доклинической идентификации возникающих в организме нарушений здоровья, позволило на основе высокоспецифичных и чувствительных тестов получить представление о сущности возникающих нарушений, их патогенезе, следить за тенденцией развития и интенсивности их, а также о времени завершения репаративных процессов в стадии реконвалесценции, и судить о витальном и функциональном прогнозе болезней. Установлено, что все виды обмена веществ и все обменные реакции протекают при активном участии ферментов.
На этой основе использование ферментных (энзиматических) методов лабораторного исследования крови животных, особенно в условиях перевода животноводства на промышленную технологическую основу, трудно переоценить, так как чем раньше устанавливают нарушения здоровья, тем своевременней и эффективней бывают их лечение и профилактика.
Известно, что ферменты имеют белковую природу, молекулярная структура их еще недостаточно ясна. Поэтому прямых методов изучения концентрации ферментов в биологических субстратах не существует, наоборот, широко используются методы косвенного изучения их констилляций по продуктам специфической активности, что выражается, как правило, в условных единицах на единицу объема субстрата при стандартных температурных условиях и рН. Клиническое значение при этом имеют 3 типа изменений ферментного зеркала в организме:
1) понижение активности или исчезновение имеющихся в крови ферментов (гипоферментемия, аферментемия);
2) повышение их активности и концентрации (гиперферментемия);
3) появление в крови ферментов, несвойственных здоровому организму (неоферментемия).
Клиническая биохимия приводит все большее число примеров, снидетельствующих о нарушении функций отдельных ферментов и их координированной деятельности при самых разнообразных, порой неожиданных, ситуациях и в зависимости не только от патологических, но и от физиологических предпосылок. Кроме того, выявление гетерогенной природы ряда ферментов, связанное с открытием изоэнзимов (изоферментов), открыло новые возможности для использования ферментов в органоспецифической диагностике и терапии. Установлено много ферментов, существующих в двух и более формах (трансаминазы, энзимы конденсации, изомеразы). Как выяснилось, даже такие хорошо известные в клинике ферменты, как амилаза, фосфатаза, глюкозо-6-фосфатдегидрогемаза, фосфогексоизомераза, малат- и лактатдегидрогеназа, в организме животных представлены также в виде нескольких молекулярных структур. Однако, несмотря на эти различия, они сохраняют свою специфичность к субстрату, в каталитическом превращении которого они участвуют, что и используется при органоспецифической диагностике и идентификации метаболических изменений в организме.
Поскольку процессы обмена по своей сущности являются ферментативными, то принято считать, что в основе патогенеза различных заболеваний лежат нарушения функций энзиматических систем.
Ферменты крови (плазмы, сыворотки) по происхождению условно можно разделить на 3 группы:
1) собственные ферменты крови, например, энзимы свертывания крови (протромбин, проакцелерин, проконвертин, факторы IX — XII), церулоплазмины, холинэстераза и др.;
2) ферменты, поступающие в кровь из различных секретов (дуоденальный сок, слюна и т. п.), например амилаза, липаза;
3) клеточные ферменты, появляющиеся в крови при повреждении или разрушении клеток и тканей организма.
Огромный клинический материал свидетельствует о том, что ферментологические исследования функционального состояния органов и систем превышают по чувствительности другие применяемые с этой целью методы.
Вместе с тем недостатком многих ферментологических тестов сыворотки крови является их неспецифичность. Например, большинство клеточных ферментов, особенно основных обменных цепей (цикл Кребса, гликолитическая цепь, трансаминирование, дыхательная цепь и т. д.), встречается в большинстве тканей организма, так что по изменению их констилляций без соответствующих дополнительных комплексных клинико-лабораторных исследований трудно судить о том, какой орган и в какой степени поврежден. Это еще раз подтверждает фундаментальный принцип того, что в любом случае речь идет не о болезни отдельного органа или системы, а о болезни организма, сущность которой, патогенез и степень нарушений можно объективно распознать лишь на основе комплексного клинического исследования, изучения химизма, структуры и функций отдельных органов и систем больного организма в целом.
Каталаза крови(Н2О2: Н2О2-оксиредуктаза) расщепляет двуоксид водорода согласно уравнению 2Н2О2→2Н2О + О2. В присутствии спиртов обладает способностью переносить кислород. Окисляет спирты: метанол, этанол, п-пропанол, изопропанол, изобутанол, гликол и коламин. Благодаря довольно простой методике определение каталазной активности широко используется в лабораторной практике. Активность фермента зависит от количества эритроцитов, поэтому необходим их подсчет для интерпретации результатов исследования. Высокий индекс каталазной активности (активность энзима в единице объема крови, деленная на количество эритроцитов в млн/мм3) отмечается при пернициоз,ной и других макроцитарных анемиях. Содержание каталазы в крови при пневмониях, заболеваниях печени (цирроз, гепатит), сердца, почек (нефрит, пиелонефрит, нефросклероз), в стадии реконвалесценции колеблется в нормальных пределах. При злокачественных новообразованиях, после радиоактивного облучения активность каталазы снижается, но повышается в последние месяцы беременности и при лактации. Активность энзима падает при отравлениях фосфором, мышьяком, свинцом, ртутью, наркотиками, цианидами, сульфидами, азидами, фторидами. Кофеин, теобромин, ацетоновые тела, алкоголь повышают активность каталазы.
Каталаза активно участвует в кислородном обеспечении тех тканей, в которые кислород поступает в меньших количествах, чем необходимо для нормального течения окислительных реакций. Каталаза эритроцитов вдвое активнее каталазы печени. Определение ее активности в крови дает объективные данные для суждения о степени обеднения организма железом при анемиях.
Активность каталазы крови обычно определяют по методу Баха и Зубковой. Принцип метода основан на способности двух молекул пероксида водорода (Н2О2) разлагаться каталазой до 2Н2О и О2. Избыток пероксида водорода титруют раствором перманганата калия в присутствии серной кислоты:
2КМnО4 + 5Н2О2 + ЗН2SО4 = 2МnSО4 + 8Н2О + SО2 + К2SО4.
В опытной пробе определяют количество неразложившегося пероксида водорода в присутствии каталазы, а в контрольной пробе — общее количество его в присутствии инактивированной кипячением каталазы. По разнице между контролем и опытом рассчитывают количество распавшегося в течение определенного времени (30 мин) пероксида водорода, дающее косвенное представление о каталазной активности.
Активность каталазы (каталазное число) делят на количество эритроцитов (млн/мм3). Частное от деления представляет собой каталазный индекс, по которому судят о результатах анализа.
Лактатдегидрогеназа(ЛДГ, дегидрогеназа молочной кислоты) катализирует обратимую реакцию восстановления пировиноградной кислоты в молочную при участии НАД • Н (восстановленной формы никотинамидаденилдинуклеотида):
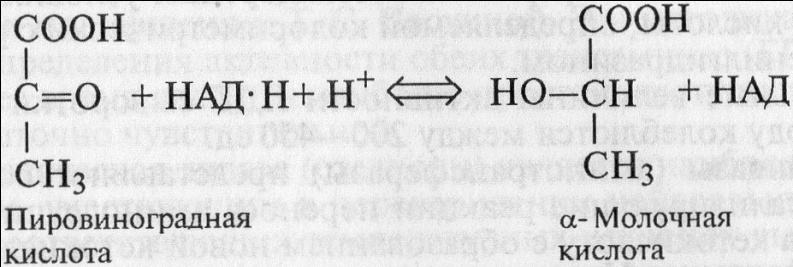
Оптимум действия фермента отмечается при рН 7,4 и температуре 39 °С, а также при рН 8,0 и температуре 20 °С. В замороженных тканях и жидкостях фермент сохраняет активность длительное время. Много его содержится в гладких и скелетных мышцах, миокарде, почках, обкладочных клетках желудочных желез, особенно в поджелудочной железе, селезенке, легких и в тканях злокачественных опухолей. В крови содержится в относительно небольшом количестве.
Оксалаты тормозят активность фермента в крови, поэтому кровь лучше стабилизировать гепарином. В гемолизированной крови активность ЛДГ многократно возрастает за счет высокой ее концентрации в эритроцитах. Продолжительное парентеральное введение ЛДГ вызывает образование в организме животных антифермента, снижающего до 75 % его активность.
Повышение активности ЛДГ в сыворотке крови бывает после хирургических операций, травмирования скелетных мышц, при мышечной атрофии не нейрогенной природы. При циррозе, воспалении печени и обтурационной желтухе отмечают лишь незначительное увеличение активности энзима. Резкое повышение ЛДГ бытает при метастазировании рака в печень. Активность ЛДГ попытается при нефрите, панкреатите, пернициозной анемии, инфаркте миокарда, гемобластозах (лейкозе, ретикулезе) и при беременности.
У новорожденных животных активность ЛДГ в 1,5—2 раза иыше, чем у взрослых.
Большую ценность для диагностики заболеваний печени имеет определение изоферментов ЛДГ сыворотки крови методом электрофоретического расщепления ее на отдельные фракции. Обычно выделяют до 5 фракций (изоферментов), из них 5-я содержится в гепатоцитах. При заболеваниях печени содержание 5-го изофермента в сыворотке крови возрастает соответственно тяжести патологического процесса.
Активность ЛДГ определяют по Шенеду и Товареку. Принцип метода состоит в способности а-лактата в щелочной среде в присутствии ЛДГ и НАД окисляться в пируват, по количеству которого судят об активности фермента. Определение активности ЛДГ в сыворотке крови проводят также по методу Нейтельсона. Об активности ЛДГ сыворотки крови судят по количеству образовавшейся под действием фермента в стандартных условиях пировиноградной кислоты, определяемой колориметрически с реактивом динитрофенил гидразином.
Нормальные величины активности ЛДГ сыворотки крови по этому методу колеблются между 200—450 ед.
Трансаминазы(аминотрансферазы) представляют собой ферменты, катализирующие реакции переноса аминогрупп с аминокислоты на кетокислоту с образованием новой кетокислоты и новой аминокислоты. Известно несколько трансаминаз, но в клинической практике наиболее широко исследуют активность глютаминопировиноградной (ГПТ) и глютаминощавелевоуксусной (ГОТ) трансаминаз (глютаминоаспарагиновой и глютаминоалани-новой трансаминаз, или АСТ и АЛТ).
Коэнзимом трансаминаз является лиридоксальфосфат. Сульфат магния повышает активность фермента вдвое. Трансаминазы довольно стабильны и в холодильнике сохраняют активность до 3 нед. После 6-месячного хранения сыворотки крови в холодильнике при 4 °С активность фермента снижается на 40 %.
Наивысшая активность ГОТ отмечается в миокарде, печени, почках, скелетных мышцах. ГПТ в наибольших количествах содержится в печени и почках. Опухолевая ткань отличается относительно низкой активностью трансаминаз.
Наибольшую ценность определение активности трансаминаз имеет для диагностики заболеваний печени и сердца. Так, при токсических гепатитах активность трансаминаз возрастает параллельно тяжести поражения. Индекс де Ритиса (ГОТ/ГПТ) при этом приближается к единице.
При циррозе печени активность ГПТ снижается, а ГОТ — значительно возрастает, отчего индекс де Ритиса становится выше единицы. Отравление производными фосфора, токсическими плесневыми грибами повышает активность трансаминаз, а введение небольших доз четыреххлористого углерода с целью дегельминтизации при фасциолезе овец приводит к повышению транса-миназной активности в 1,5—4 раза по сравнению с нормой. Изменение активности трансаминаз считается весьма чувствительным тестом функционального состояния печени. При метастазирова-нии рака в печень активность трансаминаз колеблется в пределах 45—76 ед., причем активность ГОТ обычно выше, чем ГПТ.
При инфаркте миокарда активность ГОТ в крови значительно возрастает, в то время как активность ГПТ почти не изменяется или возрастает незначительно. При этом активность ГОТ в сыворотке крови повышается через 5—6 ч, достигая максимума через 24—30 ч от начала болезни. При благоприятном течении инфаркта миокарда к 7—10-му дню показатели активности ГОТ возвращаются к исходному уровню. При мелкоочаговых поражениях миокарда активность ГОТ повышается незначительно и через 2—3 сут восстанавливается до исходного уровня.
Активность трансаминаз определяют по методу Райтмана и Френкеля в модификации Т. С. Пасхиной. Эта методика одновременного определения активности обеих трансаминаз (ГПТ и ГОТ) и настоящее время является наиболее простой, доступной и вместе с тем достаточно чувствительной.
Панкреатическая липаза(стеапсин) является наиболее важным ферментом, участвующим в переваривании нейтральных жиров. Она при соответствующих температурных условиях вызывает не только липолиз, но и приводит к синтезу из олеиновой кислоты и глицерина липидов и глицеридов. Температурный оптимум фермента 40 °С, но его активность сохраняется даже при температурах, близких к О °С. При 45 °С он начинает распадаться и полностью разрушается при 55 °С в течение 10 мин. При комнатной температуре липаза сохраняет липолитическую активность 48 ч.
Липаза наиболее эффективно катализирует гидролиз триглицеридов. Слизистая оболочка тонкого кишечника также образует липазу, которая активируется желчью. Липаза содержится также в плазме, эритроцитах, лейкоцитах, но главным источником ее в крови служит поджелудочная железа. Содержание липа чы крови подвержено большим колебаниям и составляет 0,3— 1,5 ед/мл. Фермент выделяется с мочой в количествах от 0,1 до 0,75 ед/мин.
Активность липазы крови, как и амилазы, изменяется в зависимости от патологических состояний, особенно поджелудочной же-исчы. Так, при остром панкреатите активность ее возрастает, однако это отмечается не всегда и проявляется менее значительным повышением, чем активность амилазы. С другой стороны, повышение ее активности сохраняется более длительно, чем амилазной. Повышается активность липазы и при циррозе печени, желчнокаменной болезни с явлениями обтурационной желтухи. При инфекционных болезнях активность этого фермента падает соответственно тяжести болезни.
Холинэстеразаобладает способностью быстро инактивировать анетилхолин с образованием холина и уксусной кислоты. В настоящее время выделяют 2 вида холинэстеразы: истинную и ложную. Согласно международной номенклатуре ферментов (1962г.) для истинной холинэстеразы предложено название ацетилгидролаза ацетилхолина. Ложную холинэстеразу называют ацетилгидролазой ацилхолинов. Кроме того, выделяют самостоятельно бензоилхолинэстеразу (бензоилхолингидролазу). Для истинной холинэстеразы (ацетилгидролазы ацетилхолина) принято рабочее ее название ацетилхолинэстераза, а для ложной холинэстеразы — холинэстераза. На практике пользуются термином холинэстераза как неспецифическим названием двух этих ферментов.
Среди холиновых эфиров оптимальным субстратом истинной холинэстеразы является ацетилхолин, а ложной — бутирилхолин. Важной особенностью истинной холинэстеразы является то, что она проявляет максимальную активность в строго определенной концентрации субстрата, избыток которого тормозит ее активность. У ложной холинэстеразы это свойство отсутствует — при повышении концентрации субстрата ее активность растет. Различают оба фермента также, пользуясь избирательными субстратами и ингибиторами.
Избирательным субстратом истинной холинэстеразы является ацетил-ᵦ-метилхолин. Он легко гидролизуется истинной холинэстеразой, но устойчив к действию ложной холинэстеразы. А специфические субстраты ложной холинэстеразы — бутирилхолин и бензоилхолин — истинной холинэстеразой практически не разрушаются.
Истинная холинэстераза содержится в основном в сером веществе мозга, эритроцитах, симпатических ганглиях, двигательных концевых пластинках. Ложная холинэстераза содержится обычно в плазме крови, слизистой оболочке кишечника, поджелудочной железе и печени, однако в большинстве из перечисленных тканей и органов можно установить оба фермента.
Помимо основной функции — разрушать ацетилхолин холинэстераза влияет на клеточную проницаемость. Снижение холинэстеразной активности повышает проницаемость эритроцитов к ионам натрия и калия. В эритроцитах содержится холинэстеразы значительно больше, чем в плазме или сыворотке крови. Эритроциты содержат в основном истинную холинэстеразу (ацетилхоли-нэстеразу), а сыворотка и плазма — ложную.
Оптимум активности ацетилхолинэстеразы при рН 7,5—8,0, а холинэстеразы при рН 8,5. В раннем постнатальном периоде активность холинэстеразы находится на уровне взрослых особей, но затем снижается почти вдвое. Голодание также приводит к падению активности энзима, как и заболевания печени, являющейся депо холинэстеразы (в ней содержится в 6—7 раз больше фермента, чем в сыворотке крови). Фолиевая кислота повышает активность энзима. При кровотечениях и кровопусканиях повышается его активность. При беременности и злокачественных новообразованиях активность фермента падает.
Изучение в динамике холинэстеразной активности крови дает достоверное представление о функциональном состоянии печени. При злокачественном поражении печени холинэстеразная активность значительно и прогрессивно угасает. Острые инфекционные заболевания почти всегда вызывают уменьшение активности энзима, так же как и отравление фосфорорганическими и боевыми отравляющими веществами.
Недостаток холинэстеразы обусловливает накопление в тканях ацетилхолина, что приводит к падению тонуса парасимпатической нервной системы и, как следствие, к возникновению гиперсаливации, слезотечения, потливости, поноса, рвоты, увеличению секреции бронхиальной слизи, клоническим и тоническим судорогам. В подобных случаях для блокады парасимпатических нервов инъецируют атропин.
Определение активности холинэстеразы крови приобретает важное значение также в связи с внедрением в лечебную практику обладающих курареподобным действием холиновых эфиров дикарбоновых кислот и некоторых антихолинэстеразных препаратов.
Из состояний, связанных с повышением холинэстеразной активности сыворотки крови, клинический интерес представляет только нефритический синдром. При тяжелых нефритах активность холинэстеразы увеличивается более чем в 3 раза.
Определение активности холинэстеразы приобрело первостепенное значение в диагностике заболеваний печени, угнетение которой свидетельствует о повреждении паренхимы органа вследствие различных причин, и прежде всего отравлений.
Методика определения активности холинэстеразы в сыворотке крови по методу Хелла и Лукаша в модификации Борисова и Розенгарта состоит в определении времени, необходимого для образования стандартного количества уксусной кислоты из избытка ацетилхолина. Концентрацию и рН буферного раствора подбирают так, чтобы величина рН изменилась во время опыта не более чем на единицу и была близкой в 8,5, соответствующей оптимуму активности химической среды.
Активность холинэстеразы выражают количеством уксусной кислоты (в микромолях), образовавшейся в 1 мин под воздействием 1 мл сыворотки крови. В условиях метода образуется 1 мл 0,01 н. раствора уксусной кислоты, т. е. 10 микромолей, или в расчете на неразведенную сыворотку — 40 микромолей. Таким образом, для выражения холинэстеразной активности достаточно разделить эту величину на время опыта в минутах и внести поправку на спонтанный распад ацетилхолина.
Фосфатазыкатализируют реакцию отщепления неорганического фосфора от органических фосфорных соединений. В зависимости от оптимума активности различают кислые и щелочные фосфатазы. Кислая фосфатаза содержится в предстательной железе, печени, селезенке, почках, эритроцитах. Оптимальная активность ее при рН 3,4-6,2. Щелочная фосфатаза синтезируется в остеобластах костной ткани, транспортируется кровью и выводится печенью через желчевыводящие пути. Оптимальная активность ее при рН 8,6—9,4.
Наибольшее применение в клинике нашло определение активности щелочной фосфатазы, особенно при диагностике ранних форм алиментарных остеодистрофий (табл. 23). Так, при рахите, остеомаляции, генерализованном фиброзно-кистозном остите, гиперпаратиреоидизме активность щелочной фосфатазы возрастает в несколько раз (20—40 ед. Боданского или мг% в 1 ч при 37 °С). Механическая желтуха с обтурацией желчных путей (в отличие от гемолитической желтухи) сопровождается высокой активностью щелочной фосфатазы.
