Электрофизиологические явления в центральной нервной системе.
Нервные клетки, подобно другим клеткам организма, ограничены липопротеиновой мембраной, которая является хорошим электрическим изолятором. По обе стороны мембраны между содержимым клетки (цитоплазмой) и внеклеточной жидкостью существует электрическая разность потенциалов – мембранный потенциал. В нервных клетках изменения мембранного потенциала составляет основу деятельности клетки – переработки информации. На рис.1 представлено распределение ионов по обе стороны мембраны.
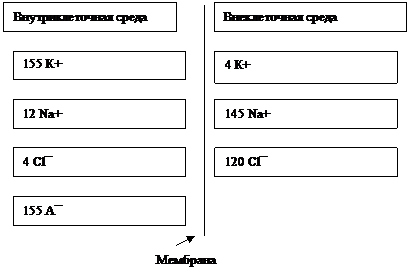 |
Рис.1 Внутри- и внеклеточные концентрации ионов для клетки теплокровного животного, ммоль/л.
В нервных и мышечных клетках мембранный потенциал долго сохраняется постоянным, если клетка не активизируется какими-либо внешними факторами. Мембранный потенциал такой покоящейся клетки называется мембранным потенциалом покоя (МПП).Потенциал покоя нервной и мышечной клетки всегда отрицателен, его величина постоянна для каждого типа клеток и колеблется в диапазоне от –50 до –100мВ.
Неравномерное распределение различных ионов между вне- и внутриклеточным пространством необходимо для существования потенциала покоя. Этот потенциал между внутриклеточной средой и межклеточной жидкостью возникает потому, что мембрана не является совершенным изолятором, а до некоторой степени проницаема для определенных ионов. Наиболее проницаема мембрана для ионов калия, несколько меньше для ионов хлора и еще менее проницаема для ионов натрия. В качестве примера, объясняющего механизмы трансмембранного движения ионов рассмотрим ток ионов калия. Можно представить, что мембрану пронизывают поры – каналы, через которые способны проходить ионы калия. Всякий раз, когда эти ионы наталкиваются на отверстие поры, они диффундируют через мембрану. Поскольку с внутренней стороны мембраны ионов калия намного больше, то такие столкновения будет происходить здесь гораздо чаще, чем снаружи, так что больше ионов будет проходить изнутри наружу, чем в обратном направлении. Наблюдается чистый выход ионов калия из клетки. При этом имеется сила, противодействующая этому процессу. Эта сила обусловлена электрическим зарядом ионов калия. По мере выхода калия из клетки уменьшается число положительно заряженных ионов на внутренней стороне мембраны. Одновременно увеличивается положительный заряд с внешней стороны мембраны. Возникающий при этом мембранный потенциал препятствует выходу катионов из клетки. Таким образом, выход положительных зарядов создаёт электрический потенциал, который мешает выходу других положительных ионов. Мембранный потенциал продолжает нарастать до тех пор, пока сила, препятствующая выходу калия, не станет равна осмотическому давлению калия. При таком уровне потенциала вход и выход калия находятся в равновесии, потому он называется калиевым равновесным потенциалом( 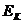 ). Величина калиевого равновесного потенциала может быть вычислена с помощью уравнения Нернста (ф.1).
). Величина калиевого равновесного потенциала может быть вычислена с помощью уравнения Нернста (ф.1).

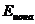 =
= 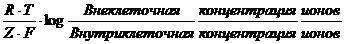 (ф.1),
(ф.1),
где R –газовая постоянная, T – абсолютная температура, Z – валентность иона и F – постоянная Фарадея. Для калия эта величина составляет –97мВ.
Мембранный потенциал действия.Если на нерв или мышцу нанести раздражение выше порога возбуждения, то МПП нерва или мышцы быстро уменьшается и на короткий промежуток времени (миллисекунда) произойдет перезарядка мембраны: ее внутренняя сторона станет заряженной положительно относительно наружной. Это кратковременное изменение МПП, происходящее при возбуждении клетки, которое на экране осциллографа имеет форму одиночного пика, называется мембранным потенциалом действия (МПД) (рис.2).
МПД в нервной и мышечной тканях возникает при снижении абсолютной величины МПП (деполяризации мембраны) до некоторого критического значения, называемого порогом генерации МПД. В гигантских нервных волокнах кальмара МПД равен –60 мВ. При деполяризации мембраны до –45 мВ (порог генерации МПД) возникает МПД.
Во время возникновения МПД в аксоне кальмара сопротивление мембраны уменьшается в 25 раз, с 1000 до 40 Ом/см2, тогда как электрическая емкость не изменяется. Указанное снижение сопротивление мембраны обусловлено увеличением ионной проницаемости мембраны при возбуждении.
По своей амплитуде (100-120 мВ) МПД на 20-50 мВ превышает величину МПП. Другими словами, внутренняя сторона мембраны на короткое время становится заряженной положительно по отношению к наружной, - «овершут» или реверсия заряда.
Причиной таких изменений мембранного потенциала является увеличение проницаемости мембраны для ионов натрия. Это происходит благодаря открытию натриевого канала. Натриевый канал представляет собой гликопротеид. Этот белок обладает способностью изменять свою конформацию при изменении величины мембранного потенциала.
Механизм, который обеспечивает открывание и закрывание ионных каналов, получил название ворот канала. Принято различать активационные (m) и инактивационные (h) ворота. Ионный канал может находиться в трех основных состояниях: закрытом (m – ворота закрыты; h – открыты), открытом (m – и h – ворота открыты) и инактивированном (m – ворота открыты; h – закрыты).
Деполяризация мембраны, вызываемая раздражающим стимулом, например, электрическим током, открывает m – ворота натриевых каналов и обеспечивает появления направленного внутрь потока положительных зарядов – ионов натрия. Это ведет к дальнейшей деполяризации мембраны, что в свою очередь, увеличивает число открытых натриевых каналов и следовательно, повышает натриевую проницаемость мембраны. Возникает «регенеративная» деполяризация мембраны, в результате которой потенциал внутренней стороны мембраны стремится достичь величины натриевого равновесного потенциала.
Причиной прекращения роста МПД и реполяризации мембраны клетки является: а) увеличение деполяризации мембраны, т.е. когда мембранный потенциал (Ем ) → ЕNа, в результате чего снижается электрохимический градиент для ионов натрия, равный Ем - ЕNа. (уменьшается сила, «толкающая» натрий внутрь клетки); б) деполяризация мембраны порождает процесс инактивации натриевых каналов (закрывание h- ворот), который тормозит рост натриевой проницаемости мембраны и ведет к ее снижению; в) деполяризация мембраны увеличивает ее проницаемость для ионов калия. Процессы инактивации натриевых каналов может быть блокирован токсинами и фармакологическими препаратами (местными анестетиками). Выходящий калиевый ток стремится сместить мембранный потенциал в сторону калиевого равновесного потенциала.
Снижение электрохимического потенциала для ионов натрия и инактивации натриевых каналов уменьшает величину входящего натриевого тока. В определенный момент времени величина входящего тока натрия сравнивается с возросшим выходящим током – рост МПД прекращается. Когда суммарный выходящий ток превышает входящий, начинается реполяризация мембраны, которая также имеет регенеративный характер. Начавшаяся реполяризация ведет к закрыванию активационных ворот (m), что уменьшает натриевую проницаемость мембраны, ускоряет реполяризацию, а последняя увеличивает число закрытых каналов и т.д.
С инактивацией натриевых каналов связано важное свойство нервного волокна, называемое рефрактерностью. Во время абсолютного рефрактерного периода нервное волокно полностью утрачивает способность возбуждаться при действии раздражителя любой силы. Относительная рефрактерность, следующая за абсолютной, характеризуется более высоким порогом возникновения МПД.
Распространение потенциала действия. При распространении потенциала действия отмечается полное возбуждение каждой точки нервного волокна, так что амплитуда потенциала действия везде одна и та же. Протекающие по принципу «всё или нечего» процессы возбуждения в разных участках мембраны связаны посредством электротонического распространения раздражающих токов вдоль волокна. Ионы натрия, которые входят в волокно в возбужденном участке мембраны, служат источником тока для возникновения деполяризующего электротонического потенциала в соседнем, еще не возбужденном участке. Когда эта деполяризация достигает порога, она вызывает в этом участке возбуждение. Таким образом, состояние возбуждения распространяется посредством электротонической связи от возбуждаемых участков мембраны к еще не возбужденным. Однако такое распространение возбуждение довольно медленное. Гораздо быстрее потенциал действия распространяется в миелинизированных нервных волокнах. Это обусловлено особенностям строения миелинизированных волокон: только очень короткие участки этих волокон (перехваты Ранвье) покрыты обычной клеточной мембраной. Поэтому при проведении ток, по существу, не идет через мембрану межперехватных участков, и потенциал действия от одного перехвата Ранвье к другому распространяется через межперхватные участки. Время проведения через межперехватные участки практически равно нулю – возбуждение перескакивает от одного перехвата к следующему (сальтаторное проведение).
Межклеточная передача возбуждения. Как мы уже отмечали выше, по нервной клетке информация передается в виде потенциалов действия. Передача информации к соседней клетке происходит через специальные межклеточные контакты – синапсы. Синапсы подразделяются на химические и электрические. В химических синапсах проведение осуществляется благодаря особым веществам – медиаторам, а в электрических синапсах решающее значение для проведения имеет специфическое распределение токов. Нами будут рассмотрены синапсы первого типа, поскольку именно они обеспечивают сложное взаимодействие клеток в организме человека.
На рисунке 3 показаны важнейшие компоненты химического синапса. Распространяющийся по аксону потенциал действия вызывает деполяризацию пресинаптической мембраны, что приводит к высвобождению медиатора и поступлению его в синаптическую щель. Медиатор диффундирует к плазматической мембране постсинаптической клетки (постсинаптической мембране), где происходит его взаимодействие с рецепторами. Рассмотрим эти процессы на молекулярном уровне несколько подробнее. Для этого нам потребуется, прежде всего информация о химическом строении медиаторов и их функции. Одним из наиболее распространенных медиаторов является ацетилхолин, который относится к числу возбуждающих медиаторов. К той же группе медиаторов относят и моноамины дофамин, серотонин, норадреналин, адреналин. Последние два объединены в группу катехоламинов. Среди медиаторов имеются и аминокислоты: γ-аминомасляная кислота и глицин. Оба этих медиатора оказывают тормозящее воздействие на постсинаптические клетки. Аминокислоты, моноамины и ацетилхолин представляют собой группу так называемых «классических» медиаторов. Все они – низкомолекулярные соединения, образующиеся в качестве промежуточных продуктов метаболизма. Каждый из них связывается со специфическим рецепторов постсинаптической мембраны, в результате чего повышается ее проводимость – либо для натрия (и калия) в случае передачи возбуждения, либо для калия и хлора с развитием торможения. Кроме «классических» медиаторов в межклеточном взаимодействии участвуют более сложные по химическому строению и обладающие большей молекулярной массой вещества – пептиды. К важнейшим пептидным медиаторам относят мет-энкефалин, лей-энкефалин, вещество Р, ангиотензин II, вазоактивный кишечный (интерстинальный) пептид, соматостатин, рилизинг-гормон лютеотропного гормона (люлиберин или ЛГРГ). Медиаторы накапливаются в синаптических пузырьках, ассоциированных с участками пресинаптической мембраны. Эту ассоциацию можно рассматривать как аппарат, специализированный для экзоцитоза, т.е. для выброса медиаторов в синаптическую щель. При этом медиатор поступает в синаптическую щель в виде квантов, соответствующих объему одного пузырька. Небольшое количество медиатора выделяется и в состоянии покоя, но пик поступления медиатора в синаптическую щель связан с деполяризацией пресинаптической мембраны – потенциал действия пресинаптического окончания ведет к почти синхронному высвобождению квантов медиатора, которое приводит к генерированию потенциала в постсинаптической мембране. Ключевую роль в квантовом высвобождении медиатора играет входящий ток ионов кальция.
Поступивший в синаптическую щель медиатор взаимодействует с рецептором постсинаптической мембраны, вызывая изменение ее проводимости. Механизм этого взаимодействия описан в рамках теории молекулярной рецепции – раздела биокинетики. Несколько слов об истории вопроса. В начале XX-го века П.Эрлих и И.И.Мечников сформулировали теорию боковых цепей (Нобелевская премия, 1908). Согласно этой теории на клеточной поверхности имеются особые химические соединения, которые образуют «боковые цепи». Химические соединения способны взаимодействовать с этими боковыми цепями. В результате взаимодействия происходит клеточное распознавание веществ и формирование клеточного ответа. П.Эрлих назвал эти боковые цепи рецепторами (от латинского recipere – получать, узнавать). Он сформулировал основной постулат рецепторного механизма действия химических соединений: “вещество не действует, если не фиксировано” (“corpora non agun nisi fixata”). Первое количественное описание величины ответа клетки в зависимости от концентрации добавленного химического соединения было предпринято А. Кларком в 1926г. Аналогично тому, как это сделано в ферментативной кинетике, Кларк предположил, что химические вещества находятся в избытке по отношению к рецепторам. Кроме того, он предположил, что взаимодействие химических веществ с рецепторами обратимо. В настоящее время химические вещества, способные взаимодействовать с рецепторами, принято называть лигандами ( от латинского ligo – связываю). Такое взаимодействие лигандов с рецепторами, согласно Кларку записывается так:
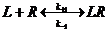 (ф.2),
(ф.2),
где L –лиганд; R – рецептор; LR – комплекс лиганда с рецептором или лиганд-рецепторный комплекс; 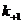 и
и 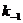 - константы скоростей образования и распада лиганд-рецепторных комплексов.
- константы скоростей образования и распада лиганд-рецепторных комплексов.
Согласно современным представлениям, большинство биологически активных веществ и лекарств оказывает воздействие на организм, регулируя функции клеток. При этом многие вещества не проникают в клетку, а оказывают свое действие опосредованно, взаимодействуя на клеточной мембране со специфическими молекулами, называемыми рецепторами. Рецепторы способны специфически распознать биологически активное вещество, обратимо или необратимо взаимодействовать с ним и передавать специфический сигнал об этом взаимодействии в клетку. Под рецепторами понимают макромолекулы, расположенные на цитоплазматической мембране клеток или внутриклеточно, способные специфически взаимодействовать с ограниченным набором биологически активных веществ (лигандов) и трансформировать сигнал об этом взаимодействии в специфический клеточный ответ. Все лиганды делятся на агонисты и антогонисты. Агонистами называют лиганды, которые, связываясь с рецепторами данного типа, активно вызывают клеточный ответ. В синапсе в качестве агонистов могут выступать как медиаторы, так и другие вещества. Это обусловлено тем, что специфичность мембранных рецепторов не абсолютна. Так, в холинергическом синапсе в качестве агонистов могут выступать карбамилхолин и суберилдихолин. Другие вещества, также связывающиеся с рецепторами медиаторов, но не столь эффективно изменяющие мембранную проницаемость, называются частичными агонистами. Антагонистами называются лиганды, которые связываются с рецепторами и не вызывают активного клеточного ответа. Антагонисты препятствуют связыванию агонистов с рецепторами, угнетая клеточные функции. Связывание их может быть обратимым: спустя некоторое время антагонист отделяется от рецептора. Такие вещества называют конкурентными антагонистами,так как они конкурируют с медиаторами и их антагонистами за участки связывания. Хорошо известный конкурентный антагонист ацетилхолина в нервно-мышечном синапсе – яд кураре (d-тубокурарин). По мере повышения концентрации он блокирует все больше рецепторов, и эффект ацетилхолина ослабляется из-за уменьшения доступных мест связывания. Это приводит к уменьшению потенциала концевой пластинки и параличу мышцы.
С учетом всего вышесказанного формула Кларка будет выглядеть следующим образом:
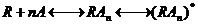 (ф.3),
(ф.3),
где n – число молекул агониста, связывающихся с одним рецептором, а переход от состояния 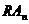 к состоянию
к состоянию 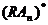 отражает сдвиг проводимости, т.е. открытие постсинаптического ионного канала. Рецепторы делятся на несколько групп. К первой из них относятся рецепторы – ионные каналы. Наиболее часто эти рецепторы представляют собой несколько белков, образующих ионный канал. В неактивном состоянии эти белки расположены так, что ионный канал закрыт. Связывание одной или нескольких белковых молекул с лигандом приводит к открытию канала и прохождению ионов в клетку или выход из клетки. В этом случае ионы могут выступать в качестве вторичных мессенджеров. Вторичными мессенджерами (от английского message – сообщение) называются внутриклеточные молекулы, осуществляющие сопряжение рецепторов с внутриклеточными эфферентными системами (ферментами, ионными каналами, геномом и т.д.). В результате лиганд-рецепторного взаимодействия концентрация вторичных мессенджеров в клетке меняется (возрастает или убывает). Известны четыре системы вторичных посредников:
отражает сдвиг проводимости, т.е. открытие постсинаптического ионного канала. Рецепторы делятся на несколько групп. К первой из них относятся рецепторы – ионные каналы. Наиболее часто эти рецепторы представляют собой несколько белков, образующих ионный канал. В неактивном состоянии эти белки расположены так, что ионный канал закрыт. Связывание одной или нескольких белковых молекул с лигандом приводит к открытию канала и прохождению ионов в клетку или выход из клетки. В этом случае ионы могут выступать в качестве вторичных мессенджеров. Вторичными мессенджерами (от английского message – сообщение) называются внутриклеточные молекулы, осуществляющие сопряжение рецепторов с внутриклеточными эфферентными системами (ферментами, ионными каналами, геномом и т.д.). В результате лиганд-рецепторного взаимодействия концентрация вторичных мессенджеров в клетке меняется (возрастает или убывает). Известны четыре системы вторичных посредников:
1) аденилатциклаза – циклический аденозин – моно – фосфат (цАМФ);
2) гуанилатциклаза – циклический гуанозин – монофосфат (цГМФ);
3) фосфолипаза С - инозитол – три – фосфат (Ифз);
4) ионизированный кальций.
Система аденилатциклаза – цАМФ. Мембранный фермент аденилатциклаза может находиться в двух формах – активированной и неактивированной. Переход этого фермента из неактивной в активную форму происходит под влиянием лиганд-рецепторного комплекса, образование которого приводит к связыванию гуанилового нуклеотида (ГТФ) с особым регуляторным стимулирующим белком (GS – белок) после этого GS – белок вызывает присоединение Mg к аденилатциклазе и ее активацию. Лиганд–рецепторные комплексы взаимодействуют в мембране клетки с другим регуляторным ингибирующим белком (GI-белок), который вызывает гидролиз ГТФ и ГДФ и, сответственно, подавление активности аденилатциклазы. Адреналин через бета – адренорецепторы активируют аденилатциклазу, а через альфа- 1 – адренорецепторы ее подавляет.
Под влиянием аденилатциклазы из АТФ синтезируется цАМФ, вызывающий активацию двух типов протеинкиназ в цитоплазме клетки, ведущих к фосфорилированию многочисленных внутриклеточных белков. Это меняет проницаемость мембран, активность и количество ферментов (табл.1).
Таблица 1. Основные эффекты фосфорилирования белков клетки цАМФ – зависимой протеинкиназой
| Виды белков | Эффекты фосфорилирования |
| Компоненты мембраны | Изменения проницаемости |
| Ферменты, лимитирующие скорость метаболического процесса | Активация или подавление |
| Белки рибосом | Активирование или подавление трансляции |
| Ядерные белки | Активирование или подавление транскрипции |
| Белки микротрубочек | Секреторный, двигательный эффекты или изменение конфигурации клетки |
Кроме активации протеинкиназ внутриклеточные эффекты цАМФ реализуются также через три других механизма: систему кальций-кальмодулин (о чем будет сказано ниже), трансметилазную систему и аденозин-5-монофосфат- аденозин. О роли системы кальций-кальмодулин будет сказано ниже. Трансметилазная система обеспечивает метилирование ДНК, всех типов РНК, белков хроматина и мембран, ряда гормонов на уровне тканей, фосфолипидов мембран.
2. Система гуанилатциклаза - цГМФ. Переход мембранной гуанилатциклазы в активную форму происходит не под непосредственным влиянием лиганд–рецепторного комплекса, а опосредованно через ионизированный кальций и оксидантные системы мембран. Типичная стимуляция активности гуанилатциклазы ацетилхолином также реализуется опосредованно через Са++. Под влиянием гуанилатциклазы из ГТФ синтезируется цГМФ, активирующий цГМФ-зависимые протеинкиназы, которые уменьшают скорость фосфорилироваия легких цепей иозина в гладких мышцах стенок сосудов, приводя к их расслаблению. В большинстве тканей биохимические и физиологические эффекты цАМФ и цГМФ противоположны. Так, цАМФ вызывает стимуляцию сокращений сердца, а цГМФ – их торможение. ЦГМФ играет роль в гиперполяризации рецепторов сетчатки глаза под влиянием фотонов света. Ферментативный гидролиз цГМФ осуществляется с помощью специфической фосфодиэстеразы.
3. Система фосфолипаза С – инозитол–3–фосфат.
Лиганд-рецепторный комплекс с участием регуляторного G – белка ведет к активации мембранного фермента фосфолипазы С, вызывающего гидролиз фосфолипидов мембраны с образованием двух вторичных посредников: инозитол–3–фосфата и диацилглицерола. Инозитол – 3 – фосфат вызывает выход Са++ из внутриклеточных депо, в основном из эндоплазматического ретикулума, ионизированный кальций связывается со специализированным белком кальмодулином, что обеспечивает активацию ряда протеинкиназ и фосфорилирование внутриклеточных структурных белков и ферментов. В свою очередь диацилглицерол способствует резкому повышению сродства протеинкинзы С ионизированному кальцию, который активирует ее без участия кальмодулина. Эти процессы также завершаются фосфорилированием других белков. Диацилглицерол одновременно может реализовывать и другой путь опосредования медиаторного эффекта, так как он активирует фофолипазу А-2. Под влиянием последней из мембранных фосфолипидов образуется арахидоновая кислота, являющаяся источником мощных по метаболическим и физиологическим эффектам веществ – простагландинов и лейкотриенов. Необходимо указать, что в разных клетках превалирует один или другой пути образования вторичных посредников, что в конечном счете и определяет физиологический эффект лиганда.
4. Система Са – кальмодулин. Ионизированный кальций поступает в клетку после образования лиганд-рецепторного комплекса либо из внеклеточной среды за счет активирования медленных кальциевых каналов мембраны (как это происходит, например, в миокарде) либо из внутриклеточных депо, под влиянием вышеописанных внутриклеточных процессов. В цитоплазме немышечных клеток кальций связывается со специальным белком-кальмодулином, а в мышечных клетках роль кальмодулина выполняет тропонин С. Связанный с кальцием кальмодулин изменяет свою конформацию, что приводит к активации многочисленные протеинкиназ, обеспечивающих фосфорилирование белков. Другим механизмом действия комплекса кальций - кальмодулин является активация фосфодиэстеразы цАМФ, что подавляет ее эффект как вторичного посредника. Кратковременное увеличение в клетке кальция и ее связывание с кальмодулином является пусковым стимулом для многочисленных физиологических процессов – сокращения мышц, секреции гормонов и выделения медиаторов, синтеза ДНК, изменения подвижности клеток, транспорта веществ через мембраны, изменения активности ферментов.
В значительной части клеток организма присутствуют или могут образовываться почти все из рассмотренных выше вторичных посредников (исключением является цГМФ). Это обуславливает различные взаимосвязи между вторичными посредниками: 1) равноправное участие, когда разные посредники необходимы для медиаторного эффекта; 2) один из посредников является основным, а другой лишь способствует реализации эффектов первого; 3) посредники действуют последовательно (например, инозитол – 3- фосфат обеспечивает освобождение кальция, диацилглиццерол облегчает взаимодействие кальция с протеинкиназой С); 4) посредники дублируют друг друга для обеспечения избыточности с целью надежности регуляции; 5) посредники являются антагонистами, т.е. один из них включает реакцию, а другой тормозит (например, в гладких мышцах сосудов инозитол–3–фосфат и кальций реализуют их сокращение, а цАМФ – расслабление).
Эффект от воздействия биологически активного вещества во многом зависит от того, с каким типом рецепторов он образовал лиганд-рецепторную связь. В группу рецепторов – ионных каналов входят, в частности, Н-холинорецепторы. Вторая группа рецепторов образована рецепторами, сопряженными с ферментами. Для этих рецепторов характерна каталитическая активность одной из образующих их молекул белка. Лиганд – рецепторное взаимодействие приводит к изменению каталитической активности данной субъединицы, а значит и синтеза внутриклеточных вторичных мессенджеров. По такому механизму функционируют рецепторы факторов роста, инсулиновые рецепторы и др. К третьей группе рецепторов относятся рецепторы, сопряженные с G-белками. G-белки – это особые ГТФ-связывающие белки, расположенные на внутриклеточной стороне цитоплазматической мембраны. Посредством этих белков рецепторы могут изменять активность внутриклеточных ферментативных систем и вызывать открытие ионных каналов. К G-сопряженным рецепторам относятся, например, β-адренорецепторы. G-белки представляют собой гетерогенную популяцию, различающиеся за счёт α-субъединицы. Имеется насколько видов G-белков:
1) 
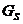 - белки. Оказывают стимулирующее влияние на аднилатциклазу, оказывает ингибирующее влияние на медленный тип кальциевых каналов.
- белки. Оказывают стимулирующее влияние на аднилатциклазу, оказывает ингибирующее влияние на медленный тип кальциевых каналов.
2) 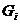 - белки. Оказывают ингибирующее воздействие на аденилатциклазу, активируют цАМФ-фосфодиэстеразу.
- белки. Оказывают ингибирующее воздействие на аденилатциклазу, активируют цАМФ-фосфодиэстеразу.
3) 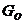 -белки. Их активация приводит к угнетению потенциал-зависимых кальциевых каналов и стимуляции калиевых каналов.
-белки. Их активация приводит к угнетению потенциал-зависимых кальциевых каналов и стимуляции калиевых каналов.
4) 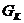 -белки. Вызывают активацию калиевых каналов и угнетение аденилатциклазы.
-белки. Вызывают активацию калиевых каналов и угнетение аденилатциклазы.
5) 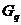 -белки. Приводят к активации фосфолипазы С.
-белки. Приводят к активации фосфолипазы С.
Процессы, происходящие при воздействии тормозящих и возбуждающих медиаторов на рецепторы постсинаптической мембраны различны. Под воздействием возбуждающего медиатора на постсинаптической мембране возникает возбуждающий постсинаптический потенциал (ВПСП). Данные изучения ионных механизмов ВПСП указывают на то, что ВПСП представляет собой результат кратковременного повышения проводимости для мелких катионов. Другим вариантом развития событий может быть возникновение торможения. Известны два типа торможения – пресинаптической и постсинаптическое. При пресинаптическом торможении уменьшается или прекращается высвобождение медиатора из пресинаптических нервных окончаний, а при постсинаптическом торможении снижается возбудимость сомы и мембраны дендритов. Тормозящий постсинаптический потенциал (ТПСП) по своей сути представляет собой гиперполяризацию постсинаптической мембраны. Возникновение ТПСП связано с тем, что при действии тормозящего медиатора на постсинаптическую мембрану повышается проницаемость последней для ионов калия и хлора. Торможение, вызываемое ТПСП, обусловлено как гиперполяризацией мембранного потенциала, так и начальным повышением проводимости мембраны.
В качестве гистологического субстрата пресинаптического торможения удобнее всего рассматривать аксо-аксональные синапсы. В ходе проведенных различными учеными исследований было установлено, что снижение количества высвобождаемого медиатора в случае пресинаптического торможения связано с активацией именно этого вида синапсов. В механизме пресинаптического торможения большую роль играет деполяризация первичных афферентов (ДПА). Активация аксо-аксонного синапса сопровождается деполяризацией постсинаптической области. Такую деполяризацию можно зарегистрировать внутриклеточно в первичных афферентах спинного мозга, откуда она и получила свое название. ДПА сопровождается уменьшением амплитуды пресинаптического потенциала в результате инактивации натриевых каналов. В конечном счете, может происходить полная блокада проведения в пресинаптических окончаниях, сопровождающаяся высвобождением очень небольшого количество медиатора.
После того, как медиатор диффундировал через синаптическую щель, дальнейшая его диффузия из этого узкого пространства идет довольно медленно и не способна заметно снизить установившуюся концентрацию.
Важнейшим, с точки зрения физиологии, вопросом является взаимодействие между синапсами. И действительно, первый же шаг от этого элементарного уровня взаимодействия двух клеток возбудимых тканей вверх по шкале размерностей, первый же шаг к пониманию целостной функциональной организации нервной системы требует рассмотрения этого взаимодействия.
Объединяясь между собой посредством синапсов, нейроны формируют изумительные по сложности системы, чьё функционирование и определяет, в конечном счетё, высшие функции центральной нервной системы. Здесь мы рассмотрим лишь наиболее простые из этих нейронных сетей. Эти элементарные нейронные цепи служат, например, для усиления слабых сигналов, уменьшения слишком интенсивной активности, выделения контрастов, поддержания ритмов или сохранения рабочего состояния нейронов путём регулировки их входов. Сама собой напрашивается аналогия с интегральными электрическими цепями – стандартными элементами, которые выполняют наиболее часто повторяющиеся операции, и могут быть включены в схемы самых разнообразных электронных приборов. Эти простейшие нейронные системы расположены во всех отделах головного и спинного мозга и характеризуются некоторым набором структурно функциональных феноменов, к числу которых относится конвергенция, дивергенция, временная и пространственная суммация (облегчение), различные виды торможения и реверберации.
Афферентные волокна, несущие сигнал от периферических рецепторов, сначала входят в спинной мозг в составе дорсальных корешков, а затем ветвятся на много коллатералей, идущих к спинальным нервам. Таким образом один чувствительный нейрон оказывает влияние на несколько других нейронов. Это явление получило название дивергенция. Благодаря дивергенции афферентная информация поступает одновременно к разным участкам ЦНС. Тут следует отметить, что разветвление волокон дорсальных корешков является лишь частным случаем дивергенции. Это явление обнаруживается во всех отделах центральной нервной системы, что позволяет говорить о принципе дивергенции в нейронных сетях.
В качестве структурной и функциональной противоположности дивергенции мы с полным основанием можем рассматривать конвергенцию. При этом явлении несколько нейронов оказывают влияние на функцию одного нейрона. Число таких входов для одного нейрона очень велико (на мотонейроне оканчивается до 6000 коллатералей аксонов), а само явление столь широко представлено в ЦНС, что мы с полным основанием можем говорить о принципе конвергенции в нейронных связях. Благодаря конвергенции возможно интегрирование различным потоков информации на одном нейроне, что является одним из важнейших процессов, происходящих в ЦНС.
В случае, если возбуждающие постсинаптические потенциалы (ВПСП) быстро следуют друг за другом, то они суммируются благодаря своему относительно медленному временно́му ходу, достигая в конце концов порогового уровня. Это повышение возбудимости нейрона в результате последовательно возникающих ВПСП носит название временно́го облегчения. Временное облегчение ответа на активность аксона обусловлено тем, что ВПСП продолжается дольше, чем рефрактерный период аксона. Временное облегчение играет очень важную роль, потому что многие нейронные процессы имеют ритмический характер и, таким образом, могут суммироваться, давая начало надпороговому возбуждению в синапсах.
Для пространственного облегченияхарактерна суммация ВПСП, возникающих одновременно в разных синапсах. В результате этого возникает распространяющийся потенциал действия – процесс, который не может быть обеспечен одиночным ВПСП. Если рассматривать в целом оба вида облегчения, то можно сказать, что облегчение возникает в том случае, когда количество импульсов больше, чем сумма отдельных входов.
Выше мы уже отмечали, что кроме нейронных цепей, в которых происходит облегчение, существуют и простые тормозные цепи, для которых характерны различные типы торможения. Изучение их мы начнем с возвратного торможения. Эта форма торможения возникает в том случае, когда тормозные вставочные нейроны действуют на те же нервные клетки, которые их активируют. При этом торможение бывает тем глубже, чем сильнее было предшествующее возбуждение. Это позволяет использовать кибернетический принцип обратной связи для описания этих цепей, а само возвратное торможение рассматривать как торможение по принципу обратной связи. Частным случаем возвратного торможения является торможение Реншоу. Этот вид торможение встречается в мотонейронах: мотонейроны посылают коллатерали к вставочным нейронам (клеткам Реншоу), аксоны которых в свою очередь образуют тормозные синапсы на мотонейронах.
Латеральное торможение. При данном виде торможения тормозные вставочные нейроны соединены таким образом, что они влияют не только на возбужденную клетку, но и на соседние клетки с такими же функциями, в которых возбуждение отсутствует или является более слабым. В результате в этих соседних нейронах развивается очень глубокое торможение. Поскольку при этом возбужденный нейрон оказывается со всех сторон окруженным зоной торможения, это явление также называют окружающим торможением. Латеральное торможение играет особенно важную роль в афферентных системах.
Реципрокное торможение. Для изучения данного вида торможения необходимо ввести некоторую терминологию. Гомонимными называются все те нейроны, которые посылают аксоны к одной и той же мышце. Мышцы-агонисты, или синергисты, осуществляют движение в суставе в одном и том же направлении, а мышцы-антагонисты - в противоположных направлениях. Нервные волокна, идущие по направлению к гомонимным мотонейронам, образуют на этих нейронах возбуждающие синапсы, а посредством вставочного нейрона – тормозные синапсы на мотонейроны мышц-антагонистов. Если повышается тонус нервных волокон, идущих к мотонейронам мышц-сгибателей, то они оказывают тормозящие влияние на мотонейрон, иннервирующий мышцу-разгибатель, действующую на тот же сустав. Это торможение имеет большой физиологический смысл, потому что обеспечивает согласование тонуса мышц и облегчает движение в суставе автоматически, без дополнительного произвольного или непроизвольного контроля.
