Основные процессы извлечения газообразных примесей
Абсорбция
 Рис. 4.8. Схема образования пылевого слоя на волокнах Рис. 4.8. Схема образования пылевого слоя на волокнах |
Общие сведения абсорбционной очистки газов. Абсорбционная очистка основана на способности жидкостей растворять газы или химически взаимодействовать с ними. При абсорбции происходит переход вещества из газовой фазы в жидкую, при десорбции, наоборот, из жидкой в газовую фазу. Вещество, которое содержится в газовой фазе и при абсорбции переходит в жидкую фазу, называют абсорбционным компонентом, или абсорбтивом. Вещество, которое содержится в газовой фазе и при абсорбции не переходит в жидкую фазу, называют газом-носителем. Вещество, в котором происходит растворение абсорбируемых компонентов, называют абсорбентом. В отличие от абсорбируемых компонентов остальную часть газового потока обычно называют инертным газом.
Различают физическую и химическую абсорбцию (хемосорбцию).
При физической абсорбции происходит физическое растворение абсорбируемого компонента в растворителе, которое не сопровождается химической реакцией. Абсорбция происходит в том случае, если парциальное давление абсорбируемого компонента в газовой фазе больше равновесного парциального давления над данным раствором. Для многократного использования поглотитель подвергают регенерации, при этом извлекают из него абсорбированный компонент.
При химической абсорбции абсорбируемый компонент вступает в химическую реакцию с поглотителем, образуя новые химические соединения в жидкой фазе. Здесь возможны два варианта — протекание обратимой и необратимой реакции. Хемосорбционные процессы обеспечивают более полное извлечение компонентов из газовых смесей. Регенерацию поглотительных растворов, получаемых при протекание обратимых хемосорбционных процессов, проводят теми же методами, что и при физической абсорбции. Регенерацию поглотительных растворов, получаемых в необратимых хемосорбционных процессах, осуществляют химическими методами.
Количество газов, которое может раствориться в жидкости, зависит от свойств газов и жидкости, а также от условий растворения: температуры жидкости и парциального давления газа над жидкостью.
При абсорбции происходит передача массы абсорбируемого компонента (массопередача) от газа к жидкости.
Массопередача в абсорбционных системах. Массопередача представляет собой сложный процесс, состоящий из процессов переноса вещества в каждой из фаз (массоотдача) и переноса вещества через границу раздела фаз (рис. 4.9).
При обычном для практики турбулентном движении газового потока, в случае контакта его с орошающей жидкостью ближе к границе раздела фаз «Г»–«Ж», образуются ламинарные слои, причем на самой границе предполагают, что эти слои неподвижны.
Подобный подход позволяет принять, что сопротивление перехода вещества на границе фаз отсутствует, т. е. на границе раздела фаз существует равновесие.
Уравнение массоотдачи можно записать в виде
G = b F Dp , (4.49)
где G — масса вещества, переносимого в единицу времени, кг/c; b — коэффициент массоотдачи, представляющий собой массу вещества, переносимую внутри фазы в единицу времени через единицу поверхности при движущей силе, равной единице, кг/(м2 с) на единицу движущей силы; F — поверхность контакта фаз, м2; Dp — движущая сила процесса.
Движущая сила в газовой фазе обычно выражается как разница парциальных давлений Dр, а в жидкой фазе обычно выражается как разница концентраций Dс.
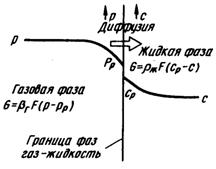 Рис. 4.9. Схема процесса массопередачи на границе раздела фаз газ–жидкость Рис. 4.9. Схема процесса массопередачи на границе раздела фаз газ–жидкость |
При абсорбции из газовой фазы вещества с парциальным давлением р в жидкую, с концентрацией с уравнения массоотдачи будут иметь вид
G = bг×F×(p – pp); (4.50)
G = bж×F×(cp – c), (4.51)
где bг, bж — коэффициенты массоотдачи, соответственно, в газовой и жидкой фазе; рр — парциальное давление абсорбционного компонента на границе фаз, Па; ср — концентрация абсорбируемого компонента на границе раздела фаз, кг/м3.
Исходя из условий равновесия фаз у поверхности их соприкосновения
рр = mp cp, (4.52)
где mp — константа фазового равновесия, Па×м3/ кг (рис. 4.10).
Для идеальных растворов, растворимость газов которых подчиняется закону Генри, константа фазового равновесия зависит от концентрации и температуры, увеличиваясь с возрастанием последней. При этом, соответственно, уменьшается растворимость газа, в связи с чем, для проведения процесса абсорбции желательны более низкие температуры.
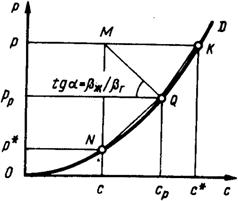 Рис. 4.10. Зависимость парциального давления от концентрации Рис. 4.10. Зависимость парциального давления от концентрации |
При сильном разбавлении любой раствор приближается к идеальному, что также делает возможным применение закона Генри. Поэтому этот закон достаточно точно описывает равновесие для плохо растворимых газов.
Для газов со сравнительно высокой растворимостью он справедлив при относительно низких концентрациях; при более высоких концентрациях растворимость обычно ниже, чем это следует из закона Генри.
В этих случаях величина mp начинает зависеть от состава поглотителя, и линия равновесия, характеризующая взаимосвязь параметров р и с, описывается кривой. Значение константы равновесия для водных растворов газов приводятся в литературе.
Константа фазового равновесия в общем случае зависит от давления, температуры и концентрации абсорбента в жидкости. В некоторых случаях она может быть вычислена на основании термодинамических свойств газа и жидкости, но в большинстве случаев ее определяют опытным путем.
После преобразования уравнений массоотдачи можно получить уравнение массопередачи
G = Kм F (р – р*), (4.53)
где Км — коэффициент массопередачи, с/м; р* — парциальное давление абсорбируемого компонента, равновесное его концентрации в жидкости с, т. е. условно (р* = mp c), Па.
Коэффициент массопередачи характеризует интенсивность протекания процесса в абсорбере. Движущая сила характеризует требуемую степень извлечения абсорбируемого компонента.
Величина Км определяется из выражения
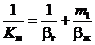 , (4.54)
, (4.54)
где m1 — среднее значение константы фазового равновесия, определяемое по формуле
 (4.55)
(4.55)
Аналогичное уравнение можно получить и относительно концентрации компонентов жидкости. В этом случае среднее значение константы фазового равновесия m2 определяется по формуле
 , (4.56)
, (4.56)
где с* — концентрация абсорбируемого компонента в жидкости, равновесная его парциальному давлению в газовой фазе, кг/ м3.
В уравнениях массопередачи, в отличие от уравнений массоотдачи, движущая сила выражается не в виде разности реально существующих парциальных давлений абсорбируемого компонента или его концентраций в жидкости (хотя величины рри ср не поддаются непосредственному измерению), а в виде разности между реальной величиной (р и с) и некоторой фиктивной (р* и с*), не существующей в неравновесном процессе.
В уравнении (4.54), определяющем Км и 1/bг характеризует сопротивление массопередаче, оказываемое в газовой фазе, а член 1/bж — сопротивление жидкой фазы. Сумма этих величин 1/Км является общим сопротивлением массопередачи.
Доля каждого из фазовых сопротивлений в общем сопротивлении определяется главным образом значением величины m1. При небольших m1 (хорошо растворимые газы) член m1/bж мал. В этом случае сопротивлением жидкой фазы можно пренебречь и принимать Км»bг. При больших значениях m1 (плохо растворимые газы), наоборот, член m1/bж становится большим по сравнению с 1/bг. В этом случае Км » bж m1. При средних значениях m1 (умеренно растворимые газы) сопротивление каждой из фаз выражается величинами одного порядка и пренебрегать ни одной из них нельзя.
Разделение газов на хорошо, плохо и умеренно растворимые достаточно условно, так как для одного и того же газа зависит от многих факторов. Однако, условно можно принять, что при m1 < 1 газы рассматриваются как хорошо растворимые, при m1>100 как плохо растворимые, а при m1 = 1¸100 как умеренно растворимые.
Примерами хорошо растворимых газов являются аммиак (NH3), фтористый и хлористый водород (HF и HCI); плохо растворимых — диоксид углерода (CO2), кислород, азот; умеренно растворимых — диоксид серы (SO2), хлор (приведенные данные относятся к растворению указанных газов в воде).
Проблемы при расчете процесса абсорбции связаны с определением движущей силы процесса и коэффициентов массопередачи (массоотдачи). Имеется целый ряд теорий, предлагающих различные методы расчета приближенных значений этих величин.
При расчетах используют число единиц переноса (аналог движущей силы процесса)
 , (4.57)
, (4.57)
где р1 – р2 — изменение парциальных давлений абсорбируемого компонента; Dрср — средняя движущаяся сила процесса.
Используют также высоту единицы переноса (аналог коэффициента массопередачи)
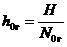 , (4.58)
, (4.58)
где Н — рабочая высота аппарата, м.
Выражение (4.57) может быть записано и для жидкой фазы.
Единицу переноса можно рассматривать как элемент абсорбера, в котором изменение концентрации абсорбируемого компонента равно средней движущей силе в пределах данного элемента. Высота единицы переноса соответствует высоте скруббера, для которого число единиц переноса равно единице. Чем меньше h0 г, тем интенсивнее протекает абсорбционный процесс.
Для определения числа единиц переноса могут использоваться методы графического интегрирования, графический и метод численного интегрирования, которые изложены в специальной литературе.
Хемосорбция. При хемосорбции концентрация абсорбируемого компонента в жидкой фазе уменьшается, что приводит к увеличению градиента концентрации и ускорению процесса абсорбции. Скорость процесса в этом случае зависит не только от скорости массообмена, но и от скорости химического взаимодействия компонентов.
Причем здесь возможны два случая: когда лимитирующей стадией процесса является скорость химического взаимодействия (кинетическая область) или скорость диффузии абсорбируемого компонента в зону реакции (диффузионная область)
Скорость абсорбции осложненной химической реакцией в жидкой фазе рассчитывают используя так называемый фактор ускорения Ф:
 , (4.59)
, (4.59)
где b'ж и bж — коэффициенты массопередачи в жидкой фазе соответственно при хемосорбции и при физической абсорбции.
Тогда коэффициент массопередачи
 , (4.60)
, (4.60)
Значение Ф может быть определено по специальным номограммам.
(Для расчетов этих же величин в различной специализированной научно-технической литературе предлагаются и другие формулы.)
Адсорбция
Общие сведения адсорбционной очистки газов. Поглощаемое из газовой фазы вещество в процессе адсорбции называется адсорбтивом, а твердое вещество, на поверхности которого или в порах которого происходит адсорбция поглощаемого вещества, называется адсорбентом. Газовая фаза, в которой находится извлекаемый компонент, называется газом носителем, а после того как извлеченный компонент перешел в адсорбированное состояние, его называют адсорбатом.
Явление адсорбции обусловлено наличием сил притяжения между молекулами адсорбента и адсорбтива на границе раздела соприкасающихся фаз. Процесс перехода молекул адсорбтива из газа носителя на поверхностный слой адсорбента происходит в том случае, если силы притяжения адсорбента превосходят силы притяжения, действующие на адсорбтив со стороны газа носителя.
Рассмотрим схему кристаллической решетки твердого тела (рис. 4.11). Атом «А», находящийся внутри кристалла, имеет шесть ближайших соседей, все его связи задействованы, и он не обладает свободной энергией. У атома «Б», находящегося на поверхности кристалла, только пять ближайших соседей, он имеет одну условную свободную связь и поэтому обладает большей энергией и находится в более высоком энергетическом состоянии, чем атом внутри кристалла. Еще большей энергией обладает атом «В», находящийся на грани кристалла. У него четыре ближайших соседа и, следовательно, большой избыток энергии. Самым большим избытком энергии обладает атом «Г», лежащий на вершине кристалла. У него всего три ближайших соседа (и три условно свободные связи). Этот избыток энергии называется поверхностной, и она является причиной адсорбции.
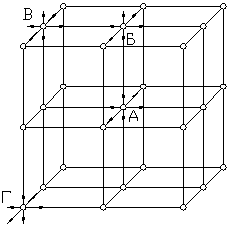 Рис. 4.11. Схема кристаллической решетки адсорбента Рис. 4.11. Схема кристаллической решетки адсорбента |
Молекулы адсорбированного вещества, переходя на поверхность адсорбента, уменьшают его энергию, в результате чего происходит выделение теплоты. Теплота физической адсорбции сравнительно невелика и составляет до 60 кДж/моль.
Силы притяжения адсорбента могут иметь различную природу — физическую или химическую. В соответствии с этим, различают физическую и химическую адсорбцию.
При физической адсорбции взаимодействие молекул с поверхностью адсорбента определяются сравнительно слабыми дисперсными, индукционными и ориентационными силами. При этом адсорбированные молекулы не вступают с молекулами адсорбента в химическое взаимодействие и сохраняют свою индивидуальность. Для физической адсорбции характерна высокая скорость, малая прочность связи между поверхностью адсорбента и адсорбтивом и малая теплота адсорбции. С повышением температуры количество физически адсорбированного вещества уменьшается, а увеличение давления приводит к возрастанию величины адсорбции.
Преимуществом физической адсорбции является легкая обратимость процесса. При уменьшении давления адсорбента в газовой смеси, либо увеличении температуры, адсорбируемые молекулы легко десорбируются без изменения химического состава, а регенерированный адсорбент может использоваться многократно.
Высокая скорость физической адсорбции и способность адсорбентов к регенерации позволяет вести процесс циклично в условиях обратимости, т. е. с чередованием стадий поглощения и выделения извлекаемых компонентов.
В основе химической адсорбции лежит химическое взаимодействие между адсорбентом и адсорбируемым веществом. Действующие при этом силы значительно больше, чем при физической адсорбции, а высвобождающееся при этом тепло совпадает с теплом химической реакции. Как правило, она колеблется в пределах от 20 до 400 кДж/моль. Из-за такой большой теплоты адсорбции энергия связи хемосорбируемых молекул сильно отличается от энергии связи этих же молекул в потоке газа. Соответственно, и энергия, необходимая для того, чтобы хемосорбированная молекула прореагировала с молекулой другого сорта, может быть существенно меньше, чем энергия, необходимая для реакции этих же молекул в газовой фазе. Этим объясняется тот факт, что адсорбированная на поверхности твердого тела молекула легче вступает в химическую реакцию с другими молекулами. Существует и другое важное отличие химической адсорбции: молекула абсорбтива, вступив в химическое взаимодействие, прочно удерживаются на поверхности и в порах адсорбента. Характерной особенностью химической адсорбции является и то, что скорость ее при низких температурах мала и возрастает с ростом температуры.
Адсорбция газов происходит в несколько стадий. Первой стадией является перенос молекул газа к внешней поверхности твердого вещества, и эта стадия аналогична диффузии молекул газа через стационарный слой к границе раздела фаз газ — жидкость при абсорбции. Вторая стадия адсорбции заключается в том, что молекулы газа проникают в поры твердого вещества, третьей стадией является собственно адсорбция молекулы в определенной области поры. Собственно адсорбция в порах протекает очень быстро по сравнению с двумя первыми стадиями.
Наибольшее значение для очистки газов имеет физическая адсорбция.
Скорость адсорбции. Скорость процесса адсорбции определяется скоростью подвода (диффузии) адсорбтива к внешней поверхности гранул адсорбента либо скоростью перемещения адсорбтива в порах адсорбента, либо зависит от обеих этих стадий. Скорость подвода адсорбтива к внешней поверхности адсорбента зависит от скорости газа-носителя, температуры, коэффициента диффузии адсорбтива в газе-носителе, вязкости и плотности среды. Скорость перемещения адсорбтива внутри гранул зависит от размера гранул адсорбента, диаметра пор, размеров молекулы адсорбтива, температуры и других факторов.
Характер протекания процессов адсорбции зависит от того, как протекает процесс — периодически или непрерывно. Периодические процессы, как правило, проводят с неподвижным слоем адсорбента, а непрерывные — с движущимся или кипящим слоем.
С повышением температуры количество адсорбированного вещества уменьшается. Процесс адсорбции в этих условиях графически выражается изобарой адсорбции (рис. 4.12), показывающей изменение количества адсорбированного вещества a в зависимости от температуры при постоянном давлении. С повышением концентрации адсорбтива над поверхностью адсорбента, при постоянной температуре, активность адсорбента увеличивается. Однако, это увеличение продолжается лишь до определенного момента, когда наступает полное насыщение адсорбента, т. е. когда наступает максимальная поглотительная емкость адсорбента. Любые твердые вещества обладают поверхностью и, следовательно, потенциально являются адсорбентами. В технике, однако, используют адсорбенты с сильно развитой внутренней поверхностью, образование которой достигается в процессе их синтеза или в результате специальной обработки.
Одними из основных свойств адсорбентов является динамическая емкость (временем защитного действия), размеры пор и избирательность адсорбентов.
Адсорбционная емкость адсорбентов. Различают статическую и динамическую емкость адсорбентов. Статическая емкость соответствует равновесному состоянию системы. Она показывает, какое количество вещества способен адсорбировать адсорбент в условиях равновесия, т. е. когда концентрация адсорбтива на входе и на выходе становится одинаковой. Динамическая емкость адсорбента соответствует поглощению вещества слоем адсорбента от начала адсорбции до начала «проскока» адсорбтива, т. е. когда в выходящем из слоя адсорбента газе-носителе появляются следы адсорбтива.
Так как концентрация адсорбтива в газе-носителе обычно выражается в граммах на литр, граммах на моль, парциальным давлением в паскалях, либо отношением парциального давления к давлению насыщенного пара (P/PS), то адсорбционная емкость (активность) может быть выражена в граммах поглощенного вещества на 100 г адсорбента или моль на грамм, сантиметр кубический на грамм, процент по массе и др.
Адсорбционная емкость адсорбента зависит от его природы. Она возрастает с увеличением поверхности, пористости, снижением размеров пор адсорбентов, а также с повышением концентрации адсорбтива в газе-носителе и давления в системе. С увеличением температуры и влажности адсорбционная емкость адсорбентов снижается. Поэтому перед использованием их подвергают прокалке (просушке), а процесс десорбции ведут при почти таких же температурах и давлениях.
Важно, чтобы адсорбент после длительной работы не терял свою активность и мог адсорбировать такое же количество вещества, как и в начале процесса. Хорошие адсорбенты выдерживают несколько сотен и тысяч циклов адсорбция-десорбция без существенной потери активности.
Пористая структура адсорбентов. Поверхность адсорбентов формируется за счет формы каркаса, из которого построено пористое тело. Различают внешнюю и внутреннюю поверхности. Внешняя поверхность зависит от количества макропор. Она невелика и составляет 0,5–2 м2/г, т. е. 0,2–0,5% от общей поверхности адсорбента. Внутренняя поверхность образуется за счет стенок микропор и средних пор в зависимости от их объема и размеров может достигать 500–1000 м2/г.
Поры адсорбентов образуются за счет пустот между частицами, из которых построен каркас пористого тела. Эти частицы могут иметь форму шара, эллипса, цилиндра, волокон и т. д.
Поры в твердых телах подразделяются на: макропоры с радиусом более 1000–2000 Å и микропоры с радиусом до 15 Å. Макропоры, с размерами пор более 1000–2000 Å, оказывают небольшое влияние на статистику адсорбции, но являются транспортными каналами для подвода адсорбируемых молекул к мезопорам и микропорам. В макропорах и мезопорах наблюдается послойный механизм адсорбции, в то время как в микропорах, размер которых соизмерим с размерами адсорбируемых молекул, адсорбция носит характер объемного заполнения. Поэтому для микропористых адсорбентов объем пор, а не поверхность адсорбента, играет решающее значение в адсорбционных процессах.
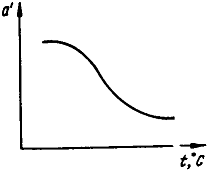 Рис. 4.12. Изобара адсорбции Рис. 4.12. Изобара адсорбции |
Адсорбент с крупными порами лучше адсорбирует вещества с большими размерами молекул и при больших давлениях. Среднепористый адсорбент эффективнее адсорбирует при средних давлениях, а мелкопористый — при низких давлениях. Энергия адсорбции в микропорах значительно выше, чем в макропорах и переходных порах. Это объясняется тем, что адсорбированные молекулы, размер которых соизмерим с размером пор адсорбента, взаимодействуют с обеими стенками поры, выделяя при этом больше тепла, чем при адсорбции молекул одной стороной стенки. Удельный объем микропор в адсорбентах достигает 0,2–0,6 см3/г, а удельная поверхность — до 500 м2/г и более. В связи с этим, микропоры играют основную роль при разделении газовых смесей, особенно при очистке газов от малых концентраций примесей.
Избирательность адсорбентов. Избирательность адсорбентов — это способность адсорбировать из газовых смесей индивидуальные вещества с определенными физико-химическими свойствами. Избирательность адсорбентов значительно зависит от их структурных свойств, так как именно от размера пор зависит их способность адсорбировать молекулы различной величины. Если средний радиус пор значительно больше радиуса адсорбируемых молекул, то такие поры могут лишь частично адсорбировать такие молекулы. Эффективная адсорбция может быть лишь в том случае, когда средний радиус пор имеет тот же порядок, что и адсорбируемые молекулы.
Катализ
Общие сведения каталитической очистки газов. Каталитическая очистка газов основана на гетерогенном катализе и служит для превращения примесей в безвредные соединения. Процесс протекает на поверхности твердых тел — катализаторов. В настоящее время вопрос о том, какие реакции и в присутствии каких веществ могут возбуждаться, остается решенным не полностью и поэтому подбор катализаторов и проведение катализа в основном решается эмпирическим путем.
Для того чтобы произошла химическая реакция между атомами, молекулами и ионами, необходимо их непосредственное взаимодействие. При температуре 500 градусов в одном куб. см реакционной смеси происходит 1028 столкновений частиц в секунду. Но не каждое столкновение приводит к химической реакции. Химическая реакция происходи лишь в том случае, когда система обладает необходимым запасом внутренней энергии (активации), если частицы сближаются на расстояние, при котором происходит перекрытие их электронных облаков, а, следовательно, и перераспределение электронных плотностей. Только в этом случае может произойти разрушение старых и образование новых химических связей.
Энергия активация является основным фактором, определяющим скорость реакции. Чем больше энергия активации, тем меньше частиц обладают в системе такой энергией и тем медленнее протекает реакция. В то же время, величина энергии активации значительно меньше энергии, требуемой для разрыва старых связей, она часто компенсируется энергией, освобождаемой при образовании новых. Задача преодоления энергетических барьеров решается путем использования катализаторов, которые снижают энергию активации и тем самым увеличивают скорость химической реакции. Таким образом, роль катализаторов с энергетической точки зрения сводится к понижению энергетического барьера, который должна преодолеть система при переходе из начального состояния в конечное.
Катализ на твердых телах складывается из следующих стадий:
— внешняя диффузия реагирующих веществ к поверхности катализатора;
— внутренняя диффузия в порах зерна катализатора;
— химическая адсорбция одного или нескольких реагирующих компонентов на поверхности катализатора;
— перегруппировка атомов (химическая реакция);
— обратная диффузия продукта в порах зерна катализатора;
— диффузия продуктов от поверхности зерна.
Каждая из стадий каталитического процесса должна обладать энергией активации значительно меньшей, чем энергия активации в отсутствии катализатора, иначе каталитический процесс окажется энергетически невозможен. Общая скорость каталитического процесса определяется относительными скоростями отдельных стадий и может лимитироваться наиболее медленной из них. Различают три основные области протекания каталитических процессов: кинетическую, внешнедиффузионную и внутридиффузионную. В зависимости от стадии, лимитирующей общую скорость процесса, используются различные уравнения кинетики процесса. Говоря о лимитирующей стадии процесса, предполагают, что остальные стадии протекают настолько быстро, что в каждой из них практически достигается равновесие и свободная энергия Гиббса равна нулю.
В кинетической области суммарная скорость лимитируется скоростью химической реакции и не зависит от процессов переноса, а зависит лишь от природы реагирующих веществ. В кинетической области протекают реакции при использовании малоактивных катализаторов и при температурах близких к температуре зажигания катализаторов. Скорость таких процессов невозможно увеличить улучшением структурных свойств катализатора (увеличением микро- и макропор). Ее можно увеличить, лишь изменяя природу катализаторов, а также повышая температуру процесса. В то же время катализатор должен иметь развитую структуру микро- и макропор, обеспечивающую подвод реагирующих веществ в зону реакции.
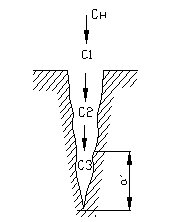 Рис. 4.13. Схема процесса переноса вещества по глубине поры катализатора Рис. 4.13. Схема процесса переноса вещества по глубине поры катализатора |
Во внешнедиффузионной области суммарная скорость каталитического процесса лимитируется скоростью подвода реагирующих веществ в зону реакции. При этом предполагается, что химическая реакция протекает мгновенно. Каталитические процессы, протекающие во внешнедиффузионной области, можно ускорить увеличивая макропоры (наружной поверхности) катализатора и перемешивая реагенты. Увеличивать поверхность микропор нецелесообразно, т. к. они практически не участвуют в процессе катализа. Пределом увеличения турбулизации потоков служит переход системы из внешнедиффузионной во внутридиффузионную или кинетическую области.
Во внутридиффузионной области суммарная скорость каталитического процесса лимитируется скоростью подвода реагирующих веществ в зону реакции в микропорах зерна катализатора. Увеличить скорость таких процессов можно путем уменьшения размеров зерна катализатора или увеличением внутренней поверхности катализатора, создаваемой тонкими порами малой длины. Большинство процессов тормозится внутренней диффузией, поэтому синтезируемые катализаторы должны обладать микропористой структурой.
Большое влияние на процесс катализа оказывает температура. Она может изменять не только скорость процесса, но и лимитирующую стадию процесса. При относительно низких температура, где скорость реакции мала по сравнению со скоростью диффузии, концентрации реагирующих веществ и продуктов реакции по глубине зерна уменьшаются незначительно и близки к концентрации их в газовом потоке, т. е. С1 = С2 = С3 = Сн (рис. 4.13). Процесс катализа протекает в кинетической области.
С ростом температуры скорость химической реакции увеличивается, увеличивается и скорость диффузии.
Однако константа скорости реакции увеличивается значительно быстрей и в этих условиях подвод реагирующих веществ путем диффузии не в состоянии обеспечить постоянную концентрацию реакционной смеси по всей глубине поры катализатора. При определенной температуре наступит момент, когда компонент вступит в химическую реакцию еще до того, как он проникнет на полную глубину катализатора, т. е. С3 = 0. Следовательно, какая-то часть внутренней поверхности поры катализатора (область а) из-за недостатка исходных веществ фактически не будет принимать участия в катализе. Таким образом, каталитический процесс переводится в область внутренней диффузии. Степень использования внутренней поверхности катализатора становится равной меньше единицы. Скорость катализа в этом случае будет лимитироваться процессом переноса вещества в микропорах катализатора. При дальнейшем увеличении температуры степень использования внутренней поверхности еще больше уменьшается, и подводимые в зону реакции вещества будут вступать в реакцию, не проникая глубоко в поры катализатора.
В определенный момент степень использования внутренней поверхности становится равной нулю, и суммарная скорость определяется только скоростью подвода реагирующих веществ из газового потока к наружной поверхности катализатора, т. е. катализ перейдет в область внешней диффузии.
Таким образом, для реакций, протекающих в кинетической области, катализатор должен обладать высокой активностью и иметь развитую внутреннюю поверхность макро- и микропор, которые обеспечивали бы подвод необходимого количества реагентов в зону реакции. Для реакций, протекающих в области внешней диффузии, мелкие поры катализатора почти не играют никакой роли, но зато возрастает значение крупных пор и внешней поверхности. В этом случае целесообразно использовать крупнопористые катализаторы с развитой внешней поверхностью. В реакциях, протекающих в области внутренней диффузии, главную роль играют мелкие поры. Для таких реакций необходимо использовать катализаторы с развитой внутренней поверхностью.
Важнейшей характеристикой катализаторов является температура зажигания — минимальная температура, при которой катализатор начинает проявлять свои свойства.
В принципе, катализаторы в ходе катализа не претерпевают никаких изменений (в некоторых процессах катализаторы работают более 20 лет). Однако постепенно активность катализаторов теряется. Причиной этого могут быть физические и химические факторы.
К физическим относятся истирание, перегрев, спекание и т. д.
Химические факторы являются значительно более сложной проблемой, возникающей в процессе каталитической очистки газов. К ним относится постепенное насыщение поверхности катализатора различными примесями, называемыми каталитическими ядами. В результате уменьшаются активные центры на поверхности катализатора и постепенно теряется активность катализатора. Одни и те же вещества могут являться каталитическими ядами для одних катализаторов и совершенно не причинять вреда другим. Если эти вещества можно удалить с поверхности катализатора, то его активность восстанавливается. В соответствии с этим различают обратимую и необратимую отравляемость катализаторов. При обратимой отравляемости их активность полностью восстанавливается после удаления каталитических ядов. При необратимой катализатор не восстанавливает их свойств даже после удаления ядов из зоны реакции. Основными каталитическими ядами являются соединения серы, свинца, фосфора и др.
Термическое окисление. Термическим называется окисление компонентов выбросов при высокой (800–1000оС) температуре. Оно применяется как в отношении газов (паров), так и горючих компонентов дисперсной фазы аэрозолей (смол, масел, летучих растворителей и др.). Основными факторами термического окисления являются: температура, интенсивность перемешивания (турбулентность газовых потоков) и время пребывания газов в реакционной зоне. Решающее значение в организации процесса имеет подготовка газов к реакции, т. е. нагрев смеси до необходимой температуры и обеспечение смешения горючих газов с окислителями. Если обезвреживаемый газ содержит в своем составе достаточное для окисления токсичных примесей количество кислорода, либо этот кислород добавляется к обезвреживаемому газу заблаговременно, то процесс смешивания газов упрощается.
Процесс термического окисления некоторых газов описывается уравнением
 , (4.61)
, (4.61)
где j — степень обезвреживания газа; t — время протекания процесса; А — эмпирический коэффициент, отражающий аэродинамические условия протекания процесса; Тк — температура в реакционной камере; Тв — температура воспламенения обезвреживаемого компонента.
С увеличением времени протекания процесса, и интенсивности турбулентной диффузии степень окисления, при неизменной температуре, существенно увеличивается. Если же параметры А и t постоянны, то увеличения степени обезвреживания можно достигнуть только за счет повышения температуры в камере.
Индивидуальные свойства окисляемого компонента учитывается введением температуры воспламенения обезвреживаемого компонента. При использовании уравнения (4.61) следует учитывать, что реакции окисления многих веществ (например, углеводородных соединений) проходят с образованием промежуточных, менее активных соединений. В этих случаях в уравнение вводят температуру воспламенения именно этого соединения.
