Частные случаи уравнения Менделеева-Клапейрона
Если в уравнении Менделеева-Клапейрона принимать некоторые из параметров за постоянные величины, то получим ряд частных уравнений.
1. Допустим, что m = const, тогда из уравнения pV=mRT/M следует, что 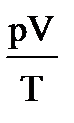 =const, или
=const, или
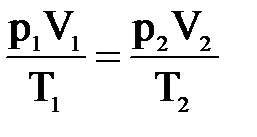
 Это уравнение называется уравнением состояния идеального газа или объединенным газовым законом.
Это уравнение называется уравнением состояния идеального газа или объединенным газовым законом.
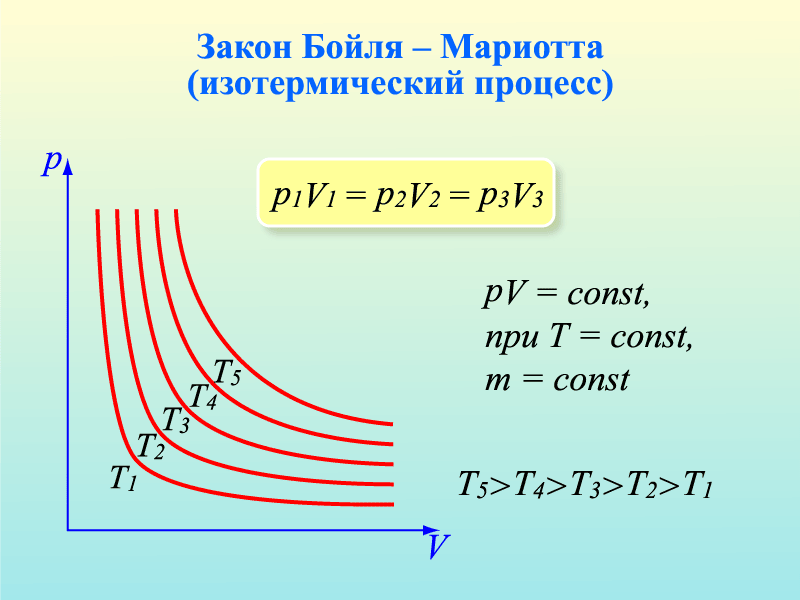
2. Допустим, что m = const и Т = const. Такие процессы называют изотермическими. Учитывая это, нетрудно заметить, что в уравнении pV=mRT/M правая часть будет постоянной при любых изменениях давления и объема, т.е. pV=const или же p1V1=p2V2
 При постоянной массе и температуре давление газа обратно пропорционально объёму - закон Бойля-Мариотта. В координатах p,V этот процесс изображается гиперболой (изотерма).
При постоянной массе и температуре давление газа обратно пропорционально объёму - закон Бойля-Мариотта. В координатах p,V этот процесс изображается гиперболой (изотерма).
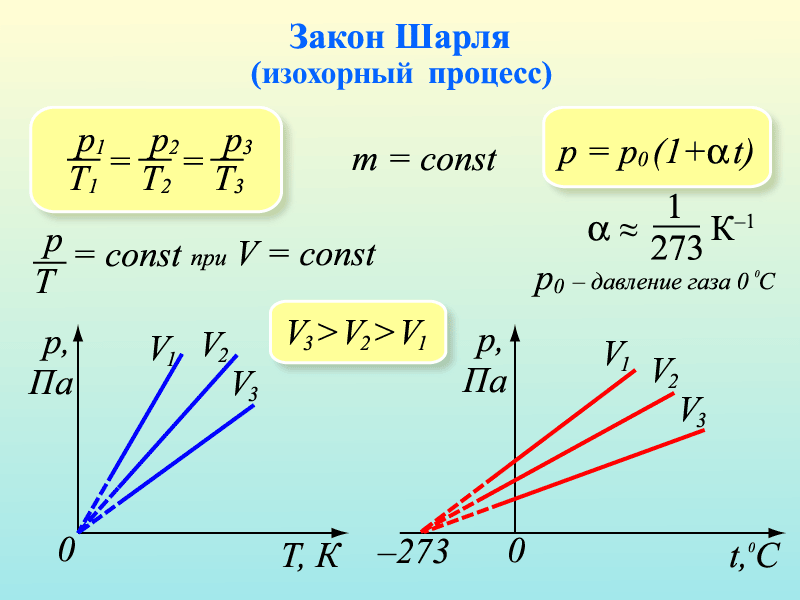
 3. Рассмотрим случай, когда m=const и V=const. Процесс с постоянным объёмом называют изохорным. Используя уравнение Менделеева-Клапейрона, можно установить связь между давлением и температурой
3. Рассмотрим случай, когда m=const и V=const. Процесс с постоянным объёмом называют изохорным. Используя уравнение Менделеева-Клапейрона, можно установить связь между давлением и температурой 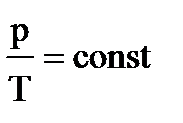 , или
, или 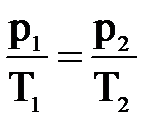 . При изохорном процессе давление идеального газа прямо пропорционально его абсолютной температуре. Эта связь была открыта французским физиком Шарлем и называется законом Шарля. График процесса называется изохорой.
. При изохорном процессе давление идеального газа прямо пропорционально его абсолютной температуре. Эта связь была открыта французским физиком Шарлем и называется законом Шарля. График процесса называется изохорой.
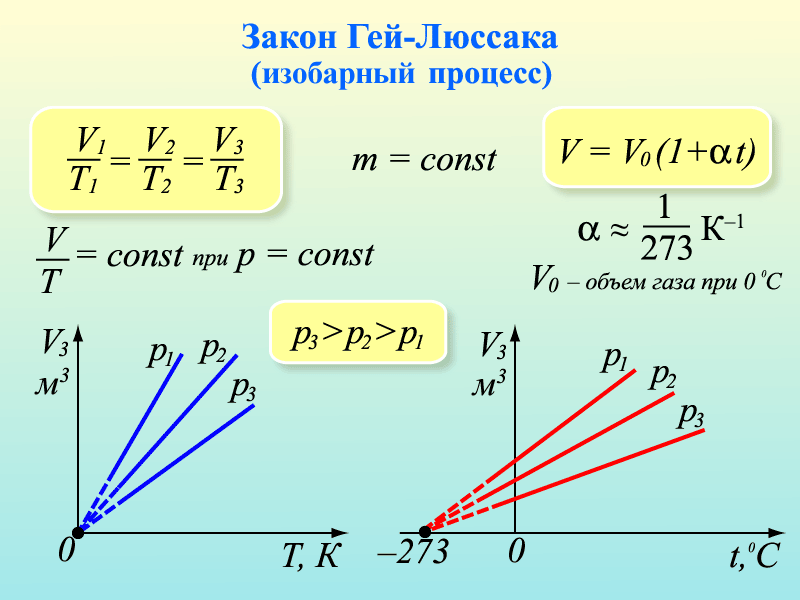
4. Примем m=const и p=const. Процесс с постоянным давлением называется изобарным. Используя уравнение Менделеева-Клапейрона, установим связь между объёмом и абсолютной температурой. Она находится как 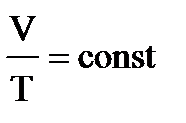 , или
, или
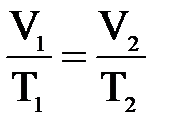 .
.
При изобарическом процессе объём идеального газа прямо пропорционален его абсолютной температуре. Связь между объемом и абсолютной температурой была установлена французским физиком Гей-Люссаком. График процесса называется изобарой.
Вопросы
Вопросы:
1. Запишите уравнение Менделеева-Клапейрона.
2. Запишите объединённый газовый закон.
3. Сформулируйте закон Бойля-Мариотта.
4. Какой вид имеет изотерма в координатах Р,V?
5. Сформулируйте закон Шарля.
6. Как выглядит изохора в координатах Р,Т?
7. Сформулируйте закон Гей-Люссака?
8. Как выглядит изобара в координатах V,Т?
ЗАДАЧИ
1. Сосуд емкостью 32×10-3 м3 наполнен азотом под давлением 9×105 Па при температуре 27°С. Определите массу азота в сосуде, если его молярная масса 0,028 кг/моль.
2. Какова температура 160×10-2 кг кислорода, находящегося под давлением 5∙106 Па и занимающего объем 16×10-3 м3? Молярная масса кислорода 0,032 кг/моль.
3. Определите давление воздуха в сосуде объемом 55×10-3 м3, если его масса 4,2×10-2 кг, температура 27°С, а молярная масса 0,029 кг/моль.
4. Определите плотность водорода при температуре 47°С и давлении 400 кПа.
5. Объем водорода при температуре 150°С и давлении 4,98×105 Па равен 2,5×10 -3 м3. Каков объем той же массы водорода при 0°С и давлении 8∙105 Па?
6. При давлении 105 Па и температуре 65°С воздух имеет объем 24×10-3 м3. При каком давлении данная масса воздуха займет объем 4×10-3 м3, если температура его станет 40°С?
7. Воздух, содержащийся в резиновом шаре, при температуре 30°С и давлении 120 кПа имеет объем 3,5 л. При погружении шара в воду, температура которой 5°С, давление воздуха увеличилось до 20×105 Па. На сколько изменился объем воздуха в шаре?
8. Какова разница в массе воздуха, заполняющего помещение объемом 150 м3, зимой и летом, если летом температура помещения достигает 30°С, а зимой падает до 0°С?
9. В баллоне при 27°С и давлении 3 МПа находится ацетилен. Каким станет давление в баллоне после расхода половины массы газа, если температура при этом понизится до 10°С?
10. Сколько молекул воздуха выходит из комнаты объемом 150 м3 при повышении температуры от 10 до 35°С? Атмосферное давление 105 Па.
ДОМАШНЕЕ ЗАДАНИЕ 7
1. Сосуд емкостью 42×10-3 м3 наполнен азотом под давлением 8×105 Па при температуре 27°С. Определите массу азота в сосуде, если его молярная масса 0,028 кг/моль.
2. Какова температура 320×10-2 кг кислорода, находящегося под давлением 5∙106 Па и занимающего объем 32×10-3 м3? Молярная масса кислорода 0,032 кг/моль.
3. Определите давление воздуха в сосуде объемом 35×10-3 м3, если его масса 2×10-2 кг, температура 27°С, а молярная масса 0,029 кг/моль.
4. Определите плотность водорода при температуре 7°С и давлении 200 кПа.
5. Объем водорода при температуре 250°С и давлении 6×105 Па равен 8,5×10 -3 м3. Каков объем той же массы водорода при 0°С и давлении 9∙105 Па?
6. При давлении 2∙105 Па и температуре 95°С воздух имеет объем 40×10-3 м3. При каком давлении данная масса воздуха займет объем 4×10-3 м3, если температура его станет 40°С?
7. Воздух, содержащийся в резиновом шаре, при температуре 35°С и давлении 120 кПа имеет объем 4,5 л. При погружении шара в воду, температура которой 5°С, давление воздуха увеличилось до 10×105 Па. На сколько изменился объем воздуха в шаре?
8. Какова разница в массе воздуха, заполняющего помещение объемом 450 м3, зимой и летом, если летом температура помещения достигает 25°С, а зимой падает до 0°С?
9. В баллоне при 27°С и давлении 1,2 МПа находится ацетилен. Каким станет давление в баллоне после расхода половины массы газа, если температура при этом понизится до 5°С?
10. Сколько молекул воздуха выходит из комнаты объемом 250 м3 при повышении температуры от 0 до 35°С? Атмосферное давление 105 Па.
11. В цилиндре дизельного двигателя автомобиля температура воздуха в начале такта сжатия была 30оС. Найти температуру воздуха в конце такта, если его объём уменьшился в 20 раз, а давление возрастает в 50 раз.
12. Во фляжке вместимостью 1,5 л находится 1л воды. Турист пьёт из неё воду, плотно прижав губы к горлышку так, что во фляжку не попадает наружный воздух. Сколько воды удастся выпить туристу, если он может понизить давление оставшегося во фляжке воздуха до 80 кПа?
11. Какова была начальная температура воздуха, если при нагревании его на 5К объём увеличился на 2% от первоначального?
12. В закрытом цилиндре по одну сторону легкоподвижного поршня имеется некоторая масса газа при температуре -70°С, по другую — такая же масса этого газа при температуре 25°С. Поршень находится в равновесии. Общий объем газа 4×10-4 м3. Определите объем газа в каждой из частей цилиндра.
V1=1.6×10-4 м3 V2=2,4×10-4 м3
13. Закрытый с обоих концов цилиндр наполнен газом и разделен легкоподвижным поршнем на две равные части длиной по 0,34 м каждая. Температура газа 27°С. На сколько градусов надо нагреть газ в одной половине цилиндра, чтобы поршень сместился на 0,1 м?
К
