Обсуждение результатов
Титульник
Содержание
Введение
Исследование процессов молекулярной самосборки (самоорганизация, самоассоциация) занимает одно из основных мест в области супрамолекулярной химии. В природе самосборка является основным фактором в формировании клеточных мембран, вторичной структуры белков, ДНК и вирусов. Явление самосборки открывает новые области применения различного типа соединений в качестве рецепторных систем, катализаторов и новых материалов. Склонность к молекулярной самосборке (самоорганизация, самоассоциация) изначально заданы функциональными параметрами молекулярных составляющих, либо содержатся в характеристиках их взаимодействий. Для создания супрамолекулярных ансамблей органические соединения (рецепторы) должны обладать соответствующим типом, количеством и пространственным расположением центров связывания, комплементарных структуре «гостя». Одним из наиболее результативных подходов к синтезу рецепторных структур, способных к супрамолекулярной самосборке, является целенаправленная функционализация макроциклической платформы [1,2]. В качестве компонентов самособирающихся систем можно использовать синтетические макроциклические платформы – мета- и парациклофаны. В качестве метациклофана будет применяться п-трет-бутилтиакаликс[4]арен, предоставляющий уникальную возможность дизайна синтетических рецепторов. В последние 5 лет объектом активного изучения стал новый класс супрамолекулярных «хозяев» - представители парациклофанов - пиллар[n]арены. Их макроциклы состоят из гидрохиноновых остатков, соединенных метиленовыми мостиками в пара-положениях, и, таким образом, обладают гидрофобным ядром, по обе стороны которого располагаются два «обода», способных к функционализации.
В рамках литературного синтеза для получения функционализированных макроциклов первоначально методика получения макроциклов, функционализированных сульфокислотными группами, способными к самоассоциации, будет отработана на модельных соединениях, в качестве которых будут выступать фенол, п-трет-бутилфенол и п-гидрохинон. Функционализация будет проводиться с помощью пропансультона. Структура синтезированных соединений будет изучена физико-химическими методами, в том числе методами ЯМР 1Н и 13С.
Целью курсовой работы является синтез сульфопроизводных фенола (2), п-трет-бутилфенол (4) и гидрохинона (6), путем подбора наиболее оптимальной методики синтеза данных веществ, с целью применения, в дальнейшем, этой методики на макроциклических объектах, таких, как каликс[4]арены и пиллар[5]арены.
В литературе известны методики синтеза сульфонатных производных каликс[5,6,8]аренов, но практически не представлены работы по синтезу аналогичных веществ на классическом п-трет-бутилкаликс[4]арене и пиллар[5]арене. В ходе работы была подобрана общая методика синтеза сульфопроизводных фенола (2), п-трет-бутилфенол (4) и гидрохинона (6) с хорошими выходами, наименьшими затратами времени и реагентов, были получены продукты высокой чистоты.
Результаты позволили применить модифицированную методику на каликсарены и пилларарены, продукты синтезов которых находятся сейчас на стадии разработки.
Литобзор
(Польза, токсичность, класс соединений, к которому принадлежит вещество, какие мтеоды получения известны.) Это все я пока не нашла.
Изначально появилась идея синтеза 1, 3-сульфопропилокси производных пилараренов, но воспроизведение методики описанной в статье для гидрохинона на пилар[5]арене не удалось. При воспроизведении синтеза на гидрохиноне так же возник ряд проблем с выделением вещества и разработкой синтеза. Тогда было принято решение рассмотрения всевозможных методик синтеза сульфопропил метокси производных гидрохинона, а так же фенола и третбутилфенола и установления наиболее оптимальных условий для проведения реакции.
Сам 1,4-3-сульфопропил оксибензол находит применение и в других отраслях химии. Он используется в качестве реагента при синтезе полупроводниковых наночастиц, имеющих светлое будущее в практических приложениях, таких как лазеры, мини-панели, дисплеи, оптические накопители, одноэлектронные транзисторы и многое другое. Эти нанокомпозиты могут найти применение в оптических усилителях, просветляющем покрытии.
(тут еще будет применение этих производных фенола. Методики у меня нет, скачаю у вас и вставлю)
Производные же каликсаренов находят широчайшее применение в химии супрамолекулярных структур. Каликсарены представляют собой циклические олигомеры, состоящие из фенольных фрагментов, связанных метиленовыми мостиками. В составе классических каликсаренов можно выделить верхний, центральный кольцевой обод и нижний обод, образованные трет-бутильными заместителями в пара-положении, ароматическими ареновыми фрагментами и гидрокси- или алкокси-заместителями в нижнем положении макроцикла соответственно. В совокупности данные структурные фрагменты формируют внутреннюю полость молекулы каликсарена, объём которой в среднем равен 10 кубическим ангстремам. Повышенный интерес к изучению структуры каликсаренов, их физико-химических свойств объясняется широкими практическими возможностями данного класса соединений. Как правило, молекулы каликсаренов имеют чашеобразную форму, и поэтому способны включать в свою полость и удерживать в ней широкий круг ионов и молекул. Благодаря наличию у них ОН-групп, каликсарены легко подвергаются химической модификации, что позволяет обеспечивать высокую селективность связывания "гостей" за счет оптимального расположения функциональных групп на ободке молекулярной "чаши", т.е. этот класс соединений успешно может быть использован в качестве платформ высокоселективных комплексообразователей в процессах экстракции. Эти циклические олигомеры способны также образовывать соли с кислотами, быть хранилищами и переносчиками различных молекул и ионов по типу "гость - хозяин".
Пилларарены являются макроциклами, состоящими из гидрохиноновых единиц (от 5 до 10), связанных в пара-положении. Они структурно похожи на каликсарены и также играют важную роль в системах гость-хозяин.
(про актуальность соединений которые мы хотим получить на основе каликсаренов)
Обсуждение результатов
1,4-3-сульфопропил оксибензол синтезировали в несколько стадий взаимодействием гидрохинона, 1,3-пропансультона и NaH в безводном ТГФ при комнатной температуре с обратным холодильником. Продукт был выделен из ацетона и воды (выход 35 %).
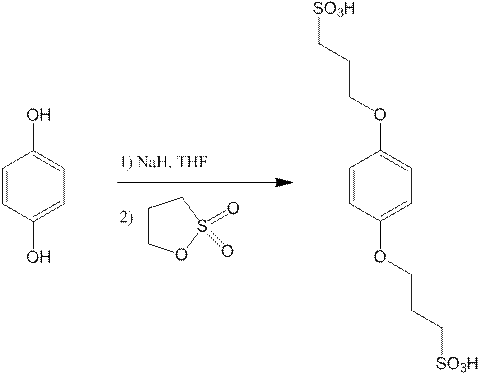
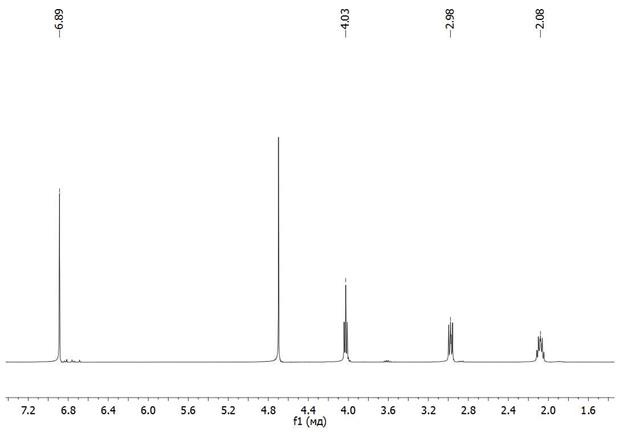
Так же был снят ЯМР С13 спектр.
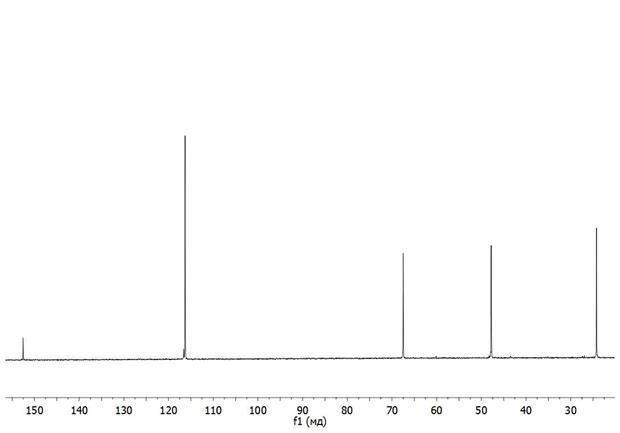
Спектр ЯМР без развязки.
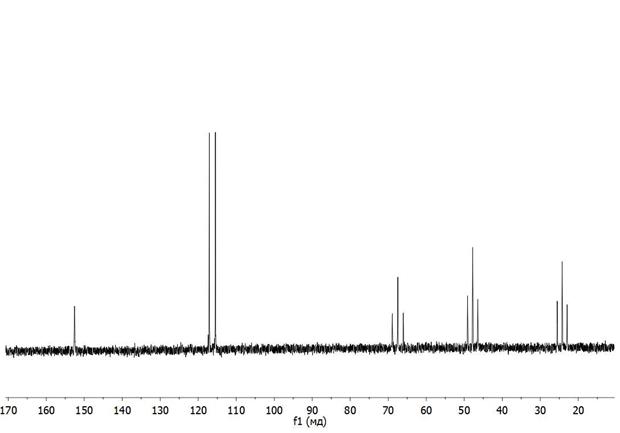
3-сульфопропил оксибензол синтезировали в несколько стадий взаимодействием гидрохинона, 1,3 пропансультона и NaH в безводном ТГФ при комнатной температуре с обратным холодильником. Продукт был выделен из ацетона и воды.
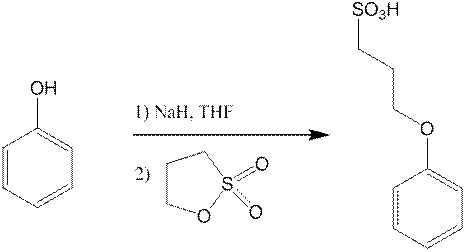
Спектр ЯМР Н1.
Так же это вещество синтезировали применяя иную методику, в которой использовали вместо гидрида натрия, гидроксид натрия и в качестве растворителя была использована смесь ТГФ и воды в соотношении 4:1. Выделяли из ацетона и воды. Синтез занимал гораздо больше времени и спектры показали, что при использовании методики с гидридом натрия продукт получается гораздо чище, однако разработка синтеза, а конкретно выделение продукта из реакционной смеси было заимствовано именно из этого способа синтеза сульфопропилокси производных бензола.
Приведенные спектры отлично доказывают структуру полученных производных фенола и гидрохинона. Однако не позволяют установить, что именно получилось в ходе синтеза сульфопропил кислота или ее натриевая соль.
ИК-спектроскопия так же не может дать ответа на этот вопрос, так как сигналы кислоты и ее соли имеют абсолютно идентичные значения.
Вещества были отданы для исследования на ионную хроматографию, результаты которых подтвердили, что синтезированные вещества являются солями.
тут результаты
Для окончательного убеждения были измерены температуры плавления веществ, которые оказались близки к 300’С, что может соответствовать только солям.
Эксперементальная часть
Часть 1.
Подготовка растворителей.
1. Высушивание гексана.
Гексан выдерживали сутки над предварительно прокаленными сита.
2. Абсолютирование ТГФ.
150 мл ТГФ держали пол часа над щелочью KOH в колбе на 250 мл. Слив декантацией, перегоняли над P2O5 методом простой перегонки с использованием дефлегматора. Ткип=66’. Перегнанный ТГФ хранили над металлическим натрием.
Подготовка исходников.
1. Очистка фенола.
53 г фенола поместили в колбу на 250 мл, бросили сита. Холодильник Либиха залили горячей водой. Сделали капилляр и открыли подачу аргона. Приготовили баню для приемника, подключили мембранный насос. При Т=60’фенол расплавился и закипел ( своя температура кипения Т=181’), собрали предгон. В начале перегонки подогревали феном насадку Вюрца, когда пошел дистиллят, кончик аллонжа, чтобы фенол не закристаллизовался. Очищенный фенол закрыли керном и убрали в холодильник.
Неочищенный фенол был ярко розового цвета, кристаллический, после перегонки стал белым порошком.
Фенол обладает специфическим запахом, таким, как запах гуаши. Фенол ядовит. Относится к высокоопасным веществам (класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги.
2. Очистка гидрохинона.
Перекристаллизовывали из ацетона по методике на 70 г на 1 мл воды при 20’.
К 7 г гидрохинона (белые кристаллы) прилили 15 мл воды, кипятили на электроплитке до растворения гидрохинона, охлаждали в морозильной камере, выпали кристаллы светло коричневого цвета. Сушили на шоте на водоструйном насосе.
Гидрохинон в отличие от фенола не представляет серьезной опасности для здоровья человека, возможны лишь химические ожоги кожи легкой формы.
Часть 2.
1. Синтез 3-сульфопропил оксибензола.
0,56 г NaH промыли на воронке со складчатым фильтром гексаном, быстро перенесли в колбу на 100 мл и прилили 5 мл ТГФ. В течение часа приливали к нему раствор 1,1 г фенола в 5 мл ТГФ, в результате чего выделялся газ. После чего добавили к смеси дополнительные 5 мл ТГФ и оставили крутиться на час. Взвесили 1,51 г пропансультона и добавили его в реакционную смесь, оставили крутиться на 3 часа. Образовывался белый раствор, который при стоянии превращался в студенистую массу.
1.1. Разработка.
В полученный продукт добавили 2 мл дистиллированной воды, выделялся газ. Померяли ph, среда была щелочная, ph=10. Подкислили 1,5 мл 2 м HCl до ph=7. Образовался раствор со взвесью. Отфильтровали его на шоте, оставшийся сухой белый порошок отдали на ЯМР Н1 в D2O. Продукт сильно пах фенолом, Померяли Тпл, >270. Спектры подтвердили ожидаемый результат. Выход 0,45 г.
2. Синтез 1,4-3-сульфопропил оксибензола.
0,56 г NaH промыли на воронке со складчатым фильтром гексаном, быстро перенесли в колбу на 100 мл и прилили 5 мл ТГФ. В течение часа приливали к нему раствор 1,3 г гидрохинона в 5 мл ТГФ, в результате чего выделялся газ и образовывалась смесь сине-зеленого цвета, причиной чему являлось предположительно образование фенолята. Добавили к смеси дополнительные 5 мл ТГФ и оставили крутиться на час. Спустя это время раствор изменил цвет на сине-черный. Добавили 3 г сультона и синий оттенок раствора пропал. Оставили крутиться на 5 часов.
2.1. Разработка.
Добавили 1 мл воды, реакционная смесь была грязно-коричневого цвета, это затруднило пронаблюдать выделение газов. Померли ph, нейтральная среда, не подкисляли. Отфильтровали на шоте, продукт имел пастообразную мягкую структуру, шоколадного цвета. Осадок растворили в 15 мл воды, подкислили HCl концентрированной до кислой среды, появился грязно-белый осадок в коричневом растворе. Провели перекристаллизацию. Добавили в эту смесь ацетон, вскипятили, добавляли по каплям воду до растворения осадка, охлаждали. Отфильтровали на шоте. Остался осадок, цветом похожий на очищенный гидрохинон, порошковой структуры. Продукт отдали на ЯМР Н1 в D2O, результаты оказались хорошими, отдали так же на ЯМР С13 в D2O, результаты которого так же оказались ожидаемыми. Выход 0,44 г.
И будет сравнение констант полученных и литературных, А.Р. сказала это сюда вставить ,не знаю зачем так..
Список литературы
1.Tan, L.; Molecular recognition and self-assembly of pillarenes / Li-Li Tan, Ying-Wei Yang // J Incl Phenom Macrocycl Chem. - DOI 10.1007/s10847-014-0441-3,
2.J. L. Atwood, J. E. D. Davies, D. D. MacNicol, F.Vogtle, J.-M. Lehn, Eds. // Oxford: Pergamon Press., 1996. - V. 9.- 687 p.
