Спектры атомов второй группы
При пренебрежении спин–орбитальным взаимодействием состояния электрона в атоме описываются четверкой квантовых чисел: 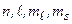 . По принципу Паули, в состояниях с этой четверкой чисел может находиться только один электрон. В состояниях с фиксированной тройкой чисел
. По принципу Паули, в состояниях с этой четверкой чисел может находиться только один электрон. В состояниях с фиксированной тройкой чисел 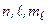 может находиться дваэлектрона. Состояниям с фиксированными числами
может находиться дваэлектрона. Состояниям с фиксированными числами 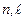 отвечают
отвечают 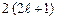 электронов. Совокупность одноэлектронных состояний с фиксированными значениями чисел
электронов. Совокупность одноэлектронных состояний с фиксированными значениями чисел 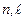 - электронная оболочка атома.Электроны с одинаковыми значениями квантовых чисел
- электронная оболочка атома.Электроны с одинаковыми значениями квантовых чисел 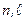 эквивалентные.Число электронов в оболочке не зависит от значения главного квантового числа. Нахождение нескольких электронов в оболочке обозначают в виде показателя степени. Например,
эквивалентные.Число электронов в оболочке не зависит от значения главного квантового числа. Нахождение нескольких электронов в оболочке обозначают в виде показателя степени. Например, 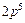 означает, что пять электронов находятся в состоянии 2р. Распределение электронов по оболочкам определяет электронную конфигурацию атома. Например, атом азота в нормальном состоянии имеет конфигурацию
означает, что пять электронов находятся в состоянии 2р. Распределение электронов по оболочкам определяет электронную конфигурацию атома. Например, атом азота в нормальном состоянии имеет конфигурацию 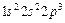 : два электрона находятся в состоянии 1s (n=1,
: два электрона находятся в состоянии 1s (n=1, 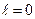 ), два других – в состоянии 2s (n=2,
), два других – в состоянии 2s (n=2, 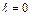 ) и, наконец, три электрона –в состоянии 2р (n=2,
) и, наконец, три электрона –в состоянии 2р (n=2, 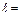 1). Совокупность оболочек с фиксированным значением главного квантового числа n образуют электронный слойатома. Для электронных слоев приняты обозначения:
1). Совокупность оболочек с фиксированным значением главного квантового числа n образуют электронный слойатома. Для электронных слоев приняты обозначения:
| n | ||||||
| Обозначение слоя | K | L | M | N | O | P |
Максимально количество электронов в слое 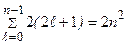 . Можно составить таблицу 4, которая изображает максимально возможное число электронов в слоях и оболочках атомов.
. Можно составить таблицу 4, которая изображает максимально возможное число электронов в слоях и оболочках атомов.
Таблица 4
| Слои | 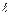 n n | (s) | (p) | (d) | (f) | (g) | 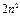 |
| K | 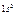 | ||||||
| L | 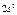 | 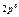 | |||||
| M | 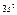  | 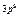 | 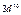 | ||||
| N | 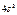 | 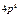 | 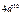 | 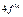 | |||
| O | 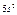 | 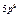 | 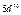 | 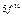 | 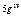 |
Электронная конфигурация характеризует распределение электронов по оболочкам атомов. Однако такого описания состояния атома недостаточно. Надо знать, как сложились орбитальные и спиновые моменты отдельных электронов и каков полный момент атома: для полного описания состояния атома необходимо знать состояния отдельных электронов, а также (при L–S –связи) числа L, S и J. В случае неэквивалентных электронов подсчет возможных термов прост. Например, в конфигурации 2p3d числа L= 1,2,3; S = = 0,1. Возможны синглетные и триплетные термы: 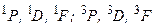 . Если электроны эквивалентны, то необходимо учитывать принцип Паули. В конфигурации
. Если электроны эквивалентны, то необходимо учитывать принцип Паули. В конфигурации 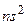 числа
числа 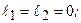
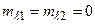 ;
; 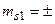 1/2;
1/2; 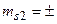 1/2. Отсюда L = 0, S = 0, 1. По принципу Паули числа
1/2. Отсюда L = 0, S = 0, 1. По принципу Паули числа 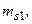
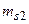 должны иметь разные знаки, при этом по принципу тождественности электронов числа
должны иметь разные знаки, при этом по принципу тождественности электронов числа 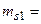 1/2,
1/2, 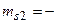 1/2 и
1/2 и 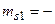 1/2,
1/2, 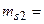 1/2 представляют то же самое состояние. Таким образом, возможен лишь синглетный терм
1/2 представляют то же самое состояние. Таким образом, возможен лишь синглетный терм 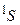 . Триплетный терм
. Триплетный терм 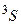 запрещен. Целиком заполненной (замкнутой) оболочке (
запрещен. Целиком заполненной (замкнутой) оболочке ( 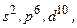 …) отвечает единственный терм
…) отвечает единственный терм 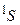 .
.
Заполнение электронных оболочек начинается с наименьших значений квантовых чисел, которые определяют наименьшее значение энергии электрона в атоме (наибольшую энергию связи). Переход от одного элемента к другому состоит в мысленном увеличении на единицу зарядового числа ядра и одновременном прибавлении к атому одного электрона, при этом стремление системы электронов находиться в состоянии с минимальной энергией ограничивается принципом Паули. Как только достигается максимально возможное число электронов в данной оболочке, начинается заполнение следующей оболочки и т.д. Указанный порядок заполнения электронных оболочек составляет оболочечную модель атома. Согласно таблице 4, число атомов в периодах системы элементов должно быть равно 2, 8, 18, 32. Это не соответствует реальному числу элементов в периодах: 2, 8, 8, 18, 18, 32, 32. Несоответствие связано с тем, что предыдущие рассуждения являются слишком идеализированными. Фактически предполагается, что электроны не взаимодействуют друг с другом, и считается, что присоединение каждого последующего электрона и увеличение заряда ядра не меняет картину кулоновского взаимодействия электронов с ядром. Такие предположения имеют ограничения. Это приводит к различным отступлениям от «правильного» порядка заполнения электронных состояний.
При небольших значениях главного квантового числа состояния с фиксированным числом n при всех значениях числа 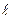 лежат ниже, чем состояния с числом n + 1. Этим определяется последовательность заполнения электронных состояний с возрастающей энергией: 1s,2s,2p,3s,3p,…Однако такая последовательность нарушается при переходе к d- и f-состояниям. В результате заполнение электронных состояний происходит в следующей последовательности:
лежат ниже, чем состояния с числом n + 1. Этим определяется последовательность заполнения электронных состояний с возрастающей энергией: 1s,2s,2p,3s,3p,…Однако такая последовательность нарушается при переходе к d- и f-состояниям. В результате заполнение электронных состояний происходит в следующей последовательности:
1s 2 электрона
2s, 2p 8 электронов
3s, 3p 8 электронов
4s, 4p, 3d 18 электронов
5s, 5p, 4d , 18 электронов
6s, 6p, 5d, 4f 32 электрона
Первый, короткий период содержит два элемента - водород с электронной конфигурацией 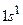 и гелий с завершенной электронной конфигурацией
и гелий с завершенной электронной конфигурацией 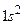 . Последующие периоды начинаются со щелочных металлов и заканчиваются благородными (инертными) газами:
. Последующие периоды начинаются со щелочных металлов и заканчиваются благородными (инертными) газами:
Таблица 5
| Щелочные металлы | Благородные газы | 2 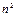 |
| (H (Z=1)) | He (Z=2) | |
| Li (Z=3) | Ne (Z=10) | |
| Na (Z=11) | Ar (Z=18) | |
| K (Z=19) | Kr (Z=36) | |
| Rb (Z=37) | Xe (Z=54) | |
| Cs (Z=55) | Rn (Z=86) | |
| Fr (Z=87) | (Z=118) |
Заполнение электронных оболочек первых восемнадцати элементов происходит в соответствии с «идеальным» порядком. 19-й электрон следующего элемента – калия должен бы находиться в состоянии 3d. Однако по своим свойствам калий – щелочной металл, как Li и Na. Эти атомы имеют валентный электрон в s–оболочке. Аналогично, 19-й электрон калия оказывается в состоянии 4 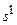 . Это подтверждается непосредственно измерениями ирасчетами, которые показывают, что энергия 19-го электрона в состоянии 4s меньше, чем в состоянии 3d. У кальция 20-й электрон также находится в состоянии
. Это подтверждается непосредственно измерениями ирасчетами, которые показывают, что энергия 19-го электрона в состоянии 4s меньше, чем в состоянии 3d. У кальция 20-й электрон также находится в состоянии 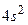 . С 21-го элемента по 30-й заполняется оболочка 3d. В шести элементах с Z=31 (Ga) до Z=36 (Kr) электроны располагаются в состоянии 4p. Очередное отступление наблюдается у 37-го элемента – рубидия. Это – щелочной металл. Его 37-й электрон находится не в состоянии 4d, а в состоянии 5s. Из таблицы Менделеева видны также другие отступления от «правильного» порядка заполнения электронных оболочек.
. С 21-го элемента по 30-й заполняется оболочка 3d. В шести элементах с Z=31 (Ga) до Z=36 (Kr) электроны располагаются в состоянии 4p. Очередное отступление наблюдается у 37-го элемента – рубидия. Это – щелочной металл. Его 37-й электрон находится не в состоянии 4d, а в состоянии 5s. Из таблицы Менделеева видны также другие отступления от «правильного» порядка заполнения электронных оболочек.
Особую группу составляют редкоземельные элементы, или лантаниды(Z = 58–71). В них с некоторыми отклонениями происходит заполнение внутренней 4f–оболочки. Внешние их оболочки одинаковы. Поэтому по своим свойствам эти элементы близки друг к другу. До Бора 72-ый элемент также относили к числу редкоземельных. Однако Бор предсказал, что свойства этого элемента должны быть аналогичны цирконию (Z = 40). Такой элемент, названный гафнием (в честь древнего названия столицы Дании), действительно был открыт в циркониевых рудах (Костер, Хевеши, 1923). Аналогия между гафнием и цирконием непосредственно следует из строения их электронных оболочек: в самом деле, оба элемента имеют аналогичную электронную конфигурацию предпоследнего слоя – 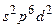 и последней оболочки –
и последней оболочки – 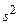 .
.
Вторая группа редкоземельных элементов начинается с 90-го элемента по 103-й - актиниды. В них с некоторыми нерегулярностями происходит заполнение глубокой внутренней оболочки 5f. 104-й элемент – резерфордий первый трансактинид и химический аналог гафния. Все элементы, начиная с 93-го, являются нестабильными и получаются искусственно. Неустойчивость тяжелых элементов связана с тем, что в их ядрах дальнодействующие силы кулоновского отталкивания протонов уже не могут быть уравновешены короткодействующими ядерными силами притяжения.
Начиная с Менделевия (элемент № 101) новые элементы синтезируются буквально в количестве нескольких атомов. Но это еще не главное препятствие на пути установления факта рождения нового элемента и оценки его свойств. Дело в том, что новые элементы являются, как правило, короткоживущими с очень малым периодом полураспада. Например, изотопы элементов с номерами 102, 103, 104 имеют период полураспада, измеряемый секундами и долями секунды, а период полураспада элемента 106 равен тысячным долям секунды. И все же физики за это время сумели доказать, что это те самые элементы, которые соответствуют своему месту в периодической системе! Современные модели атомного ядра предсказывают, что особо устойчивыми должны быть ядра, у которых число протонов или нейтронов равно «магическому числу»: 2, 8, 20, 28, 50, 82, 126. Считается, что «сверхэлементом» должно быть ядро с дважды «магическими числами» – со 126 протонами и 184 нейтронами.
