Равновесие жидкости и насыщенного пара
Рассмотрим процесс сжатия вещества при постоянной температуре. Вначале по мере уменьшения объема давление газа будет расти. До достижения объема Vг давление перестает изменяться, а вещество перестанет быть однородным – часть газа конденсируется в жидкость. Происходит расслоение вещества на две фазы: жидкую и газообразную. По мере дальнейшего уменьшения объема все большая часть вещества переходит в жидкую фазу, причем переход осуществляется при постоянном давлении. После того, как процесс конденсации заканчивается, дальнейшее уменьшение объема начинает сопровождаться быстрым ростом давления.
Назовем удельным объемом  объем единицы массы вещества. Тогда, если масса вещества равна m, удельные объемы насыщенного пара и жидкости при давлении рн.п. будут равны
объем единицы массы вещества. Тогда, если масса вещества равна m, удельные объемы насыщенного пара и жидкости при давлении рн.п. будут равны
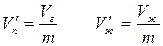
в состоянии, при котором масса жидкой фазы равна mж, а масса пара равна mп, на долю жидкости будет приходиться объем  , а на долю насыщенного пара – объем
, а на долю насыщенного пара – объем 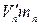 . В сумме оба эти два объема должны быть равны объему V:
. В сумме оба эти два объема должны быть равны объему V:
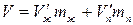
решив совместно два этих уравнения, получим

отсюда

т.о. соотношение масс жидкости и насыщенного пара в двухфазном состоянии равно отношению отрезков, на которые делит горизонтальный участок изотермы точка, изображающая состояние.
ВЫВОД ПО ДВЕНАДЦАТОМУ ВОПРОСУ:
В жидких и твердых телах при любой температуре имеется некоторое количество молекул, энергия которых оказывается достаточной для того, чтобы преодолеть притяжение к другим молекулам, покинуть поверхность жидкости или твердого тела и перейти в газообразную фазу. Переход жидкости в газообразную фазу называется испарением, переход в газообразное состояние твердого тела носит название сублимации.
Вопрос № 13
Если система является однокомпонентной, т.е. состоящей из химически однородного вещества или его соединения, то понятие фазы совпадает с понятием агрегатного состояния.
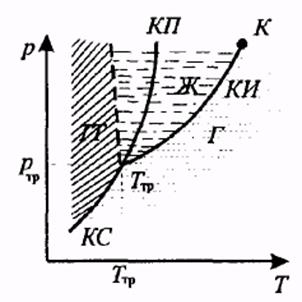
Для наглядного изображения фазовых превращений используется диаграмма состояния, на которой в координатах (р, Т)задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз.
Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз.
Тройной точкойназывается точка, в которой пересекаются кривые фазового равновесия и которая, следовательно, определяет условия (температуру Tтр и давление pтр) одновременного равновесного сосуществования трех фаз вещества.
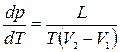 |
Уравнение Клапейрона-Клаузиуса:
