Характеристики химической связи (Ес, rс, αс, μс) и ее природа определяются типом перекрывающихся орбиталей атомов
Химическая связь между двумя атомами, которая возникает в результате перекрывания внешних атомных орбиталей и путем обобщения электронов, находящихся на этих орбиталях, называют ковалентной;
характеристики химической связи (Ес, rс, αс, μс) и ее природа определяются типом перекрывающихся орбиталей атомов.
Вопрос №28
КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
Изучение атомных орбиталей, рассчитанных с помощью уравнения Шредингера, показало, что характер движения электрона в атоме определяется четырьмя числами - n, l, m, s, получившими общее название квантовых чисел: главное, орбитальное, магнитное и спиновое.
Главное квантовое число n. Это число может принимать любые положительные целочисленные значения: n = 1, 2, 3. Определяет орбитальный радиус и соответствующий главный энергетический уровень En. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Орбитальным радиусом rорбназывают расстояние от ядра атома до наиболее удаленной точки поверхности, изображающей атомную орбиталь. Для сферической поверхности орбитальный радиус равен радиусу сферы. Для поверхности в виде песочных часов орбитальный радиус равен диаметру одной из составляющих сфер.
Главным энергетическим уровнем называют часть энергии атома, определяемойглавным квантовым числом n.

Энергия притяжения между электроном и ядром уменьшается обратно пропорционально квадрату главного квантового числа n2, а орбитальный радиус rорб увеличивается пропорционально этой величине. С увеличением числа п электрон в среднем находится все дальше от ядра. При п → ∞ энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома.
Таким образом, главные энергетические уровни Еп атома можно определять экспериментально измерением минимальной энергии, необходимой для отрыва электрона от атома. Определяемая таким способом величина называется энергией ионизации атома - I. Это очень важная характеристика атома, от которой зависят его свойства, в частности электроотрицательность. Еп уменьшается с возрастанием главного квантового числа п и орбитального радиуса rорб.
Орбитальное квантовое число l. Число l может принимать целочисленные значения: l = 0, 1, 2, n - 1, т.е. максимальное значение l не превышает n- 1, где n - главное квантовое число.
Величина l определяет форму атомной орбитали и орбитальный подуровень энергии Enl - главного энергетического уровня атома при данном n. При l = 0 форма орбитали сферическая и называется s-орбиталью. При l = 1 орбиталь имеет форму песочных часов (гантели) и называется р-орбиталью. При l = 2 форма орбитали четырехлопастная и называется d-орбиталью.
У р-орбиталей имеется узел, а у d-орбиталей узловые плоскости, где волновые функции равны нулю. Знаки лопастей чередуются. При n = 1 имеется только одна s-орбиталь и отсутствуют другие подуровни энергии и орбитали. При n = 2 имеются 2s (l = 0)- и 2р (l = 1)-орбитали разной ориентации. Им соответствуют энергетические подуровни Е2s" Е2р. При n = 3 имеются одна 3s (l = 0)-, 3р (l = 1)- и 3d (l = 2)-орбитали разных ориентаций. Им соответствуют энергетические подуровни E3s, Е3p' E3d.
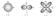
Размер атомных орбиталей разной формы возрастает с увеличением n.
Магнитное квантовое число m. Число m принимает целочисленные значения: 0, ±1, ±2, ±l. Определяют ориентацию орбиталей в пространстве, их число на данном орбитальном подуровне Enl и магнитный энергетический подуровень Enlm. На каждом орбитальном подуровне Е (l = 1) имеется три пр-орбитали с ориентацией вдоль осей х, у, z. Например, при n= 2 подуровню E2l(l = 1) соответствуют орбитали 2рх(m = ±1), 2ру(m = -1) и 2рz(m = 0) (рис. 3.3).
При n = 3 подуровню Е31 (l = 2) отвечают пять орбиталей разных ориентаций.
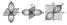
Ориентация р-атомных орбиталей при разных значениях магнитного квантового числа m.
Спиновое квантовое число s.Число s принимает два значения: +0,5 и -0,5. Характеризует собственное вращательное движение электрона. На каждой атомной орбитали двум значениям S = ± 0,5 отвечает вращение по часовой и против часовой стрелки. Соответственно имеются два спиновых подуровня энергии Enlms.
Четыре квантовых числа n, l, m, s характеризуют различные типы пространственного квантования при движении одного электрона в атоме и определяют соответствующие квантовые энергетические уровни.
Орбиталь φnlm и соответствующий энергетический уровень Enlm, определяемый четырьмя квантовыми числами n, l, m, s, называют квантовым состоянием электрона в атоме.
Электронные формулы и электронно-структурные схемы атомов.
Электронная формула описывает распределение электронов по энергетическим уровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома.
Расшифровка электронной конфигурации
По историческим причинам в формуле электронной конфигурации квантовое число l записывается латинской буквой. Состояние с L=0 обозначается буквой s,l=1 - p, l=2-d,l=3 —f,l=4 —Gи далее по алфавиту. Слева от числа l пишут число n, а сверху от числа l — число электронов в состоянии с данными n и l . Например 2s2 соответствует двум электронам в состоянии с n=2 , l=0. Из-за практического удобства (см. правило Клечковского) в полной формуле электронной конфигурации термы пишут в порядке возрастания квантового числа n, а затем квантового числа l, например  . Поскольку такая запись несколько избыточна, иногда формулу сокращают до
. Поскольку такая запись несколько избыточна, иногда формулу сокращают до 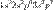 , т. е. опускают число там, где его можно угадать из правила упорядочения термов.
, т. е. опускают число там, где его можно угадать из правила упорядочения термов.
Наиболее просто электронная конфигурация представляется в виде электронной формулы атома. Для этого символы заполненных квантовых ячеек записывают в одну строчку с показателем степени, равным числу электронов в ячейке. Символы ячеек записывают в порядке повышения энергетических уровней. Например, для атома азота электронная формула оболочки имеет вид: N - 1s22s22px2py2pz, или еще короче: N - 1s22s22p3. Очевидно, что сумма степеней при символах должна равняться числу электронов Z в оболочке или номеру элемента. Для азота (Z = 7) эта сумма равна 2 + 2 + 3 = 7. Существенно, что в электронной формуле атома, как и в энергетической диаграмме, отображена последовательность расположения энергетических уровней по высоте: ls < 2s < 3s.
При поглощении энергии один или несколько электронов атома могут перейти на более высокие энергетические уровни. Такой атом называется возбужденным. В возбужденном атоме электроны занимают новые квантовые ячейки, уже не подчиняясь принципу минимальной энергии. Соответственно изменяются энергетические диаграммы и электронные формулы. Для примера - переход атома углерода из основного состояния С - 1s22s22p2 в возбужденное С* - 1s22s12p3.
Распределение электронов атома по уровням, подуровням и орбиталям (электронная конфигурация атома) может быть изображена в виде электронной формулы, энергетической диаграммы или, упрощенно, в виде схемы электронных слоев ("электронная схема").
