Ысқаша теориялық мәлімет
Ауа газ қоспасы болып, құрамы азоттан (N2), оттегінен (O2), көмірқышқыл газынан (CO2), аргоннан (Ar), су буларынан мен бір атомдық газдан тұрады. Бұл газдардың ауадағы көлемдік бөліктеріне, төмендегі мәндері сәйкес келеді:
rО2 = 0,21; rСО2 = 0,0003; rАr = 0,0093.
Атмосфералық қысымға жақын қысымдар мен бөлме температурасында ауа мүлтіксіз (идеал) газдың қасиетіне ие. Идеал газдың молекулаларының арасында өзара әрекеттестік күштер болмайды. Осы молекулалардың көлемін газдың көлемімен салыстырғанда ескермеуге болады. Сондықтан, барлық нақты газдар жоғары температура мен аз қысымда өздерінің қасиеттері бойынша іс жүзінде идеал газдың қасиеттерінен айырмашылығы болмайды.
Осыған орай ауаға мүлтіксіз (идеал) газдың қасиеттерін және күй теңдеуін қолдануға болады.
Теңдеулі күйінде идеал газдың негізгі күй параметрлерінің арасындағы өзара байланысты (1кг идеал газ үшін) Клапейрон теңдеуімен анықтауға болады:
Pν=RT немесе P=ρRT (1.1)
мұндағы P,T - абсолюттік қысым,Па,және температура,К;
ρ=1/ν= m/V – газ тығыздығы, кг/м3;
ν= m/V - меншікті көлем,м³/кг;
R - газ тұрақтысы, 1кг газ үшін, Дж/(кгК);
V,m - газдың көлемі, м3; массасы, кг.
Идеал газдың кез келген массасы үшін (m, кг) күй теңдеуінің (1.1) екі жағын m-ға көбейтіп алуға болады: ηмηг
P·ν·m = mRT немесе PV= mRT. (1.2)
Егер (1.1) теңдеуінің екі жағын да газдың молярлық массасына (μ) көбейтсек, 1Кмоль газ үшін күй теңдеуін (Клапейрон-Менделеев) жаза аламыз.
P·ν·μ= μ·RT немесе P·Vμ=μ·RT=Rμ·T (1.3)
мұндағы Vμ=μ·ν – 1Кмоль газдың көлемі, қалыпты физикалық жағдайда (Pо=1,013·105Па, Tо=273,15К) барлық газдар үшін Vμ=22,41 м3/Кмоль; μ – газдың молярлық массасы, кг/Кмоль;
Rμ= әмбебап газ тұрақтысы, барлық газдар үшін бірдей (Rμ=μ·R≈8314,2 Дж/(Кмоль·К));
Қалыпты физикалық жағдайы Rμ-дің сандық мәнін (1.3) теңдеуінен табуға болады
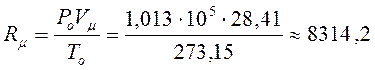 Дж/(Кмоль·К) (1.4)
Дж/(Кмоль·К) (1.4)
(1.3) әмбебап күй теңдеуін 1Кмоль газ үшін мынадай түрінде жазуға болады:
P·Vμ= 8314,2 (1.5)
Дербес газ тұрақтысы R, бұл 1кг идеал газдың жұмысы тұрақты қысымдағы процесте және оның температурасы бір градусқа (оС немесе К) өзгергендегі. Егерде газ қоспасының і-и компоненті массалық бөлігімен gіберілсе, онда идеал газдардың (ауаның) қоспасының газ тұрақтысы мына формуламен анықталады:
Rқос.есеп= 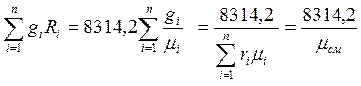 (1.6)
(1.6)
Қоспаның орта молярлық массасын оның і-и компоненттерінің молярлық массалары және көлемдік бөліктермен көрсетуге болады
μқосп= 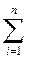 rіμі =μN2rN2 +μО2rО2+μСО2rСО2+μАrrАr (1.7)
rіμі =μN2rN2 +μО2rО2+μСО2rСО2+μАrrАr (1.7)
Авогадро заңына байланысты идеал газ үшін, газдың молярлық бөлімі Хі і-и компонентінің көлемдік бөлігіне rі –ге тең.
Газдардың молярлық массалары А қосымшасынан алынады. Егер ыдыстағы (ыдыстың ішіндегі) абсолюттік қысым Рабс, барометрлік (атмосфералық) қысымынан Рб артық болса, онда Рабс мына формуламен анықталады:
Рабс = Рб+ Рарт. ман, (1.8)
Ал егер кем болса:
Рабс = Рб – Рвак. (1.9)
(1.8) және (1.9) формулаларда Рарт (ман) және Рвак – артық (манометрлік) және вакуумдық (сиретілген) қысымдар, Па. Олар манометр және вакуумметрмен өлшенеді.
