О становлении термодинамики как науки
Термодинамика - наука о наиболее общих свойствах макроскопических материальных систем, находящихся в различных состояниях относительно термодинамического равновесия, и о процессах переходов между этими состояниями.
К настоящему времени термодинамика содержит два основных раздела:
1. Равновесная термодинамика (термодинамика изолированных систем)
В основном разработана в середине 19-го – начале 20-го века и содержит три закона – три «Начала»:
- в середине 19-го века Ю. Р. Майером, Дж. Джоулем и Г. Гельмгольцем был сформулирован первые закон термодинамики - «Первое начало термодинамики».
- в 1850 году Р. Клаузиусом, и независимо от него в 1851 году У. Томсоном было сформулировано «Второе начало термодинамики».
- в 1906 году В. Нернст сформулировал «Третье начало термодинамики».
2. Неравновесная термодинамика (термодинамика открытых систем)
Разработана в 20-м веке. Содержит два основных подраздела:
- слабо неравновесную термодинамику, основы которой разработаны в 1931 Л. Онсагером;
- сильно неравновесную термодинамику, в основном разработанную Г. Хакеном, И. Пригожиным и Р. Томом в середине 20-го века.
Первой работой в области неравновесной термодинамики в биологии является опубликованная в 1935 году книга Э.Бауэра «Теоретическая биология», в которой был сформулирован «Всеобщий закон биологии».
Система – это совокупность материальных объектов (тел), ограниченных каким-либо образом от окружающей среды.
В зависимости от характера взаимодействия с окружающей средой термодинамические системы делятся на три типа:
1) изолированная – система, которая не обменивается с окружающей средой ни веществом, ни энергией;
2) замкнутая – система, которая может обмениваться с окружающей средой лишь энергией и не может обмениваться веществом;
3) открытая – система, которая обменивается с окружающей средой и энергией, и веществом.
Живые организмы являются открытыми системами.
Состояние любой термодинамической системы характеризуется двумя группами параметров:
Интенсивными термодинамическими параметрами (давление, температура и др.), не зависящими от массы или числа частиц в системе;
Экстенсивными термодинамическими параметрами (общая энергия, энтропия, внутренняя энергия), зависящими от массы или числа частиц в системе.
Изменение параметров термодинамической системы называется термодинамическим процессом.
Энергию системы (W) можно представить как совокупность двух частей: зависящую от движения и положения системы как целого (Wц) и не зависящую от этих факторов (U).
| W=Wц+ U | (1.1) |
Вторую составляющую этой совокупности U называют внутренней энергией системы.
Она включает энергию теплового движения частиц, а также химическую и ядерную энергию, определяющую поступательное, колебательное и вращательное движение молекул, внутримолекулярное взаимодействие и колебание атомов, энергию вращения электронов.
Внутренняя энергия в свою очередь разделяется на свободную энергию и связанную энергию.
Свободная энергия (G) – та часть внутренней энергии, которая может быть использована для совершения работы.
Связанная энергия (Wсв) – та часть энергии, которую нельзя превратить в работу.
| U = G + Wсв | (1.2) |
Потоки и Термодинамические силы. В термодинамических системах, в которых имеются градиенты температуры, концентраций компонентов, химических потенциалов, возникают необратимые процессы теплопроводности, диффузии, химических реакций.
Эти процессы характеризуются тепловыми и диффузионными потоками, скоростями химических реакций и т.д.
Они называются общим термином «потоки» и обозначаются Ji, а вызывающие их причины (отклонения термодинамических параметров от равновесных значений) — термодинамическими силами (Хк).
Связь между Ji и Хк, если термодинамические силы малы, записывают в виде линейных уравнений:
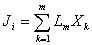 | (1.3) |
где i = 1, 2, …, m
Первое начало термодинамики - один из трех основных законов термодинамики, представляющий собой закон сохранения энергии для систем, в которых существенное значение имеют тепловые процессы.
Согласно первому началу термодинамики, термодинамическая система (например, пар в тепловой машине) может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии.
Первое начало термодинамики объясняет невозможность существования вечного двигателя 1-го рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Второе начало термодинамики
Второе начало термодинамики является законом, в соответствии с которым макроскопические процессы, протекающие с конечной скоростью, необратимы.
В отличие от идеальных (без потерь) механических или электродинамических обратимых процессов, реальные процессы, связанные с теплообменом при конечной разности температур (т. е. текущие с конечной скоростью), сопровождаются разнообразными потерями: на трение, диффузию газов, расширением газов в пустоту, выделением джоулевой теплоты и т.д.
Поэтому эти процессы необратимы, то есть могут самопроизвольно протекать только в одном направлении.
Второе начало термодинамики возникло исторически при анализе работы тепловых машин.
Само название «Второе начало термодинамики» и первая его формулировка (1850 г.) принадлежат Р. Клаузиусу: «…невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более нагретым».
Причем такой процесс невозможен в принципе: ни путем прямого перехода теплоты от более холодных тел к более теплым, ни с помощью каких–либо устройств без использования каких-либо других процессов.
В 1851 году английский физик У. Томсон дал другую формулировку второго начала термодинамики: «В природе невозможны процессы, единственным следствием которых был бы подъем груза, произведенный за счет охлаждения теплового резервуара».
Третье начало термодинамики
Третье начало термодинамики - закон термодинамики, сформулированный В. Нерстом в 1906 году (тепловой закон Нернста), согласно которому энтропия S любой системы стремится к конечному для неё пределу, не зависящему от давления, плотности или фазы, при стремлении температуры (Т) к абсолютному нулю.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать на основе первого и второго начал термодинамики. В классической термодинамике (первого и второго начал) энтропия может быть определена лишь с точностью до произвольной аддитивной постоянной S0, что практически не мешает большинству термодинамических исследований, так как реально измеряется разность энтропий (S0) в различных состояниях. Согласно третьему началу термодинамики при Т ® 0 значение DS ® 0.
Макс Планк в 1911 году дал другую формулировку третьего начала термодинамики - как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю:
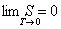 | (1.8) |
Отсюда S0 = 0. Это даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов.
Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность (W) состояния системы S = klnW.
При абсолютном нуле температуры система находится в основном квантово-механическом состоянии, если оно невырождено, для которого W = 1 (состояние реализуется единственным микрораспределением). Следовательно, энтропия S при Т = 0 равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем может стать существенной при T → 0 дискретность квантовых уровней макроскопической системы, приводящая к явлениям квантового вырождения.
Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достигнуть ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться.
Общие сведения о неравновесной термодинамике
Как было указано выше, классическая термодинамика (ее три «начала») изучает термодинамические равновесные, обратимые процессы. Для неравновесных процессов она устанавливает лишь неравенства, которые указывают возможное направление этих процессов. Фундаментальными работами И.Р.Пригожина установлено, что вся термодинамика делится на три большие области: равновесную, в которой производство энтропии, потоки и силы равны нулю, слабо неравновесную, в которой термодинамические силы «слабы», и энергетические потоки линейно зависят от сил, и сильно неравновесную, или нелинейную, где энергетические потоки нелинейны, а все термодинамические процессы носят необратимый характер. Основная задача неравновесной термодинамики - количественное изучение неравновесных процессов, в частности определение их скоростей в зависимости от внешних условий. В неравновесной термодинамике системы, в которых протекают неравновесные процессы, рассматриваются как непрерывные среды, а их параметры состояния — как полевые переменные, то есть непрерывные функции координат и времени.
Слабо неравновесная (линейная) термодинамика рассматривает термодинамические процессы, происходящие в системах в состояниях, близких к равновесию. Таким образом, линейная термодинамика описывает стабильное, предсказуемое поведение систем, стремящихся к минимальному уровню активности. Первые работы в этой области принадлежат Ларсу Онсагеру, который в 1931 году впервые открыл общие соотношения неравновесной термодинамики в линейной, слабо неравновесной области - «соотношения взаимности». Суть их чисто качественно сводится к следующему: если сила «один» (например, градиент температуры) для слабо неравновесных ситуаций воздействует на поток «два» (например, на диффузию), то сила «два» (градиент концентрации) воздействует на поток «один» (поток тепла).
Таким образом, в слабо неравновесной области практически действуют законы равновесной термодинамики, система ни к чему не стремится и ее поведение в большинстве случаев вполне предсказуемо.
Сильно неравновесная термодинамика рассматривает процессы, происходящие в системах, состояние которых далеко от равновесия.
Когда термодинамические силы, действуя на систему, становятся достаточно большими и выводят ее из линейной области в нелинейную, устойчивость состояния системы и ее независимость от флуктуации значительно уменьшается.
В таких состояниях определенные флуктуации усиливают свое воздействие над системой, вынуждая ее при достижении точки бифуркации – потери устойчивости, эволюционировать к новому состоянию, который может быть качественно отличным от исходного. Происходит самоорганизация системы. Причем считается, что развитие таких систем протекает путем образования нарастающей упорядоченности. На этой основе и возникло представление о самоорганизации материальных систем.
Все материальные системы, от самых малых до самых больших, считаются открытыми, обменивающимися энергией и веществом с окружающей средой и находящимися, как правило, в состоянии, далеком от термодинамического равновесия.
Это свойство материальных систем позволило в свою очередь определить целый ряд новых свойств материи.
Вот некоторые из них.
- все процессы необратимы, так как они всегда сопровождаются потерями энергии;
- энтропия S в открытых системах имеет две составляющие: deS – характеризует обмен энтропией с внешним миром; diS – характеризует необратимые процессы внутри;
- материя обладает свойством самоорганизации.
Исследования И. Пригожиным живой материи как открытых материальных систем были в основном сосредоточены на сравнительном анализе организации структур живой и неживой материи, термодинамическом анализе реакций гликолиза и ряде других работ.
Эволюция представлений об энтропии
Прежде чем рассматривать следующие этапы развития системного подхода и системных исследований, необходимо объяснить и уточнить некоторые понятия, которые мы уже упоминали и будем использовать в дальнейшем. Проникновение методов теории информации в физику, биологию и другие области естествознания показало тесную взаимосвязь понятия количества информации с естественно-научным понятием “энтропия”.
Понятие энтропия, первоначально введенное Р. Клаузисом лишь с целью более удобного описания работы тепловых двигателей, усилиями многих ученых, и прежде всего Л. Больцмана, стало играть универсальную роль, определяя многие закономерности в поведении макроскопических систем. В 30-е годах нашего столетия энтропия стала мерой вероятности информационных систем и явилась основой теории информации (работы Л. Сцилларда, К. Шеннона)
Связь между энтропией и вероятностью установлена Л. Больцманом и выражается знаменитой формулой, носящей имя этого ученого:
H = lnW ,
где H - энтропия, W - термодинамическая вероятность состояния.
Существенно, что Больцман, связав второй принцип термодинамики с теорией вероятности, показал, что убывание энтропии не является невозможным, а только маловероятным. Второй принцип термодинамики становится констатацией того факта, что информация теряется различными способами, что ведет к увеличению энтропии системы, но, чтобы приобрести новую информацию и уменьшить энтропию, следует произвести новые измерения, т.е. затратить энергию
В конце 40-х годов Э. Шредингер, а затем и Н. Винер существенно расширили понятие энтропии - до понимания ее как меры дезорганизации систем любой природы. Эта мера простирается от максимальной энтропии (H=1), т.е. хаоса, полной неопределенности, до исчезновения энтропии (H=0), соответствующего наивысшему уровню организации, порядка.
Таким образом, можно выделить следующие этапы развития понятия энтропии, где она выступает как:
| мера рассеяния тепловой энергии в замкнутой термодинамической системе | - | Клаузис, Больцман (1852 год) |
| мера вероятности информационных систем (мера количества информации) | - | Сциллард, Шеннон (1929 год) |
| мера дезорганизации систем любой природы | - | Шредингер, Винер (1944 год) |
С помощью энтропии стало возможно количественно оценивать на первый взгляд качественные понятия, как “хаос” и “порядок”. Информация и энтропия связаны потому, что они характеризуют реальную действительность с точки зрения именно упорядоченности и хаоса, причем если информация - мера упорядоченности, то энтропия - мера беспорядка; одно равно другому, взятому с обратным знаком. Например, если на предприятии низка трудовая и технологическая дисциплина, идет брак, то мы можем утверждать, что здесь низок уровень организации, или велика энтропия. Она угрожающе растет ныне и в нашей экономике, социальной жизни.
Энтропия и информация служат, таким образом, выражением двух противоположных тенденций в процессах развития. Альтернативность и взаимосвязь понятий энтропии и информации нашли отражение в формуле
H + J = 1 (const).
Если система эволюционизирует в направлении упорядоченности, то ее энтропия уменьшается. Но это требует целенаправленных усилий, внесения информации, т.е. управления. “Мы плывем вверх по течению, борясь с огромным потоком дезорганизованности, который, в соответствии со вторым законом термодинамики, стремится все свести к тепловой смерти - всеобщему равновесию и одинаковости, т.е. энтропии. В мире, где энтропия в целом стремится к возрастанию, существуют местные временные островки уменьшающейся энтропии, это области прогресса. Механизм их возникновения состоит в естественном или целенаправленном отборе устойчивых форм. Человек всю жизнь борется с энтропией, гася ее извлечением из окружающей среды отрицательной энтропии - информации”.
Количество информации, отождествляемое Винером с отрицательной энтропией (негэнтропией), становится, подобно количеству вещества или энергии, одной из фундаментальных характеристик явлений природы. Введение понятия энтропии в теорию информации явилось, по выражению Бройля, “наиболее важной и красивой из идей, высказанных кибернетикой”, и рассматривается как большой вклад XX века в научную мысль. Это положение называют еще вторым “краеугольным камнем” кибернетики. Отсюда - толкование кибернетики как теории организации, теории борьбы с мировым хаосом, с роковым возрастанием энтропии.
